题目内容
1.下列说法错误的是( )| A. | CaC2含C≡C键 | B. | Mg3C2含C-C键 | C. | As4S4含As-As键 | D. | S8含S=S键 |
分析 A.CaC2可水解生成H-C≡C-H;
B.Mg3C2中C元素化合价为-3价,可水解生成C2H6;
C.根据As4S4的结构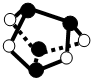 判断;
判断;
D.S8分子中每个S原子与另外2个S原子形成S-S单键.
解答 解:A.CaC2可水解生成H-C≡C-H,可知CaC2含C≡C键,故A正确;
B.Mg3C2中C元素化合价为-3价,可水解生成C2H6,则Mg3C2含C-C键,故B正确;
C.As4S4的结构为 ,可知含有As-As键,故C正确;
,可知含有As-As键,故C正确;
D.S8分子是皇冠形,上面4个硫,下面4个硫,依次连成键,一个S8分子中含8个S-S键,不含S=S键,故D错误.
故选D.
点评 本题考查化学键知识,为高频考点,侧重于学生的分析能力的考查,注意把握物质的结构和共价键的形成,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.目前人类已发现的非金属元素除稀有气体外,共有16种,对这16种非金属元素的相关判断:
①都是主族元素,最外层电子数都大于4;
②单质在反应中都只能作氧化剂;
③氢化物常温下都是气态;
④氧化物常温下都可以与水反应生成酸.其中不正确的有( )
①都是主族元素,最外层电子数都大于4;
②单质在反应中都只能作氧化剂;
③氢化物常温下都是气态;
④氧化物常温下都可以与水反应生成酸.其中不正确的有( )
| A. | 只有①② | B. | 只有①③ | C. | 只有③④ | D. | ①②③④ |
12.生活中处处有化学,下列表述不正确的是( )
| A. | 福尔马林可作食品的保鲜剂 | |
| B. | 聚乙烯塑料制品可用于食品的包装 | |
| C. | 碳酸氢钠可作胃酸的中和剂 | |
| D. | 食盐可作调味剂,也可作食品防腐剂 |
9.已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高价与最低负价绝对值相等,Z的核电荷数是Y的2倍,W最外层电子数是最内层电子数的3倍.下列说法不正确的是(
| A. | 原子半径Z>W>R | |
| B. | W与X、W与Z形成的化学键类型完全相同 | |
| C. | 对应的氢化物的热稳定性:R>W | |
| D. | Y的最高价氧化物对应的水化物是弱酸 |
16.下列装置中,铁不易被腐蚀的是( )
| A. |  NaCl溶液 | B. | 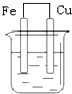 酸化的NaCl溶液 | C. | 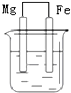 NaCl溶液 | D. |  NaCl溶液 |
13.分子式为C5H11Br且含有两个甲基的同分异构体共有(不考虑立体结构)( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
10.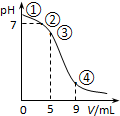 25℃时,向10mL 0.1mol•L-1 CH3COONa溶液中加入0.1mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.下列说法正确的是( )
25℃时,向10mL 0.1mol•L-1 CH3COONa溶液中加入0.1mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.下列说法正确的是( )
 25℃时,向10mL 0.1mol•L-1 CH3COONa溶液中加入0.1mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.下列说法正确的是( )
25℃时,向10mL 0.1mol•L-1 CH3COONa溶液中加入0.1mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.下列说法正确的是( )| A. | 点①所示溶液中:c(OH-)=c(H+)+c(CH3COOH) | |
| B. | 点②所示溶液中:c(CH3COOH)+c(CH3COO-)=0.05 mol•L-1 | |
| C. | 点③所示溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | 点④所示溶液中:c(Na+)+c(H+)<c(CH3COO-)+c(Cl-) |
11.下列各组化合物中,各化合物都有相同数目的同分异构体的是( )
| A. | CH2O与C2H4O2 | B. | C4H10与C4H6O | C. | CF2Cl2与C2F2Cl2 | D. | C4H10与C3H6 |