题目内容
11.下列各组化合物中,各化合物都有相同数目的同分异构体的是( )| A. | CH2O与C2H4O2 | B. | C4H10与C4H6O | C. | CF2Cl2与C2F2Cl2 | D. | C4H10与C3H6 |
分析 A.CH2O只能是甲醛,C2H4O2可以是乙酸或甲酸甲酯;
B.C4H10只能是烷烃,根据碳链异构确定同分异构体,C4H6O可以是烯醛或烯酮或环酮等;
C.根据甲烷是正四面体来解答;
D.C4H10只能是烷烃,根据碳链异构确定同分异构体,C3H6可以是烯烃或环烷烃;
解答 解:A.CH2O只能是甲醛,C2H4O2可以是乙酸或甲酸甲酯,同分异构体的数目不同,故A错误;
B.丁烷(C4H10)有2种同分异构体:正丁烷和异丁烷,C4H6O作为烯醛有:CH2=CHCH2CHO、CH3CH=CHCHO CH2=C(CH3)CHO,所以同分异构体的数目不同,故B错误;
C.根据甲烷是正四面体,CF2Cl2与C2F2Cl2是同分物质,不存在同分异构体,故C错误;
D.丁烷(C4H10)有2种同分异构体:正丁烷和异丁烷,C3H6只能是丙烯或环丙烷,所以同分异构体的数目相同,故D正确;
故选D.
点评 本题主要考查了同分异构体数目的判断,可通过同分异构体的类型进行简单判断,难度不大.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案
相关题目
1.下列说法错误的是( )
| A. | CaC2含C≡C键 | B. | Mg3C2含C-C键 | C. | As4S4含As-As键 | D. | S8含S=S键 |
2.下列气体易液化且遇挥发性酸时冒白烟,宜作制冷剂的是( )
| A. | N2 | B. | NH3 | C. | NO | D. | NO2 |
19.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 32gO2所含的氧原子数目为NA | |
| B. | 标准状况下,22.4L水中所含的水分子数目为NA | |
| C. | 1mol•L-1Na2SO4溶液中含有的钠离子数目为2NA | |
| D. | 1molMg变为Mg2+时失去电子的数目为2NA |
6.下列过程没有发生化学反应的是( )
| A. | 用活性炭去除冰箱中的异味 | |
| B. | 用热碱水清除炊具上残留的油污 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| D. | 用含硅胶、铁粉的透气小袋与食品一起密封包装 |
3.自然界中,金属硫化物矿床常因发生表生氧化及次生富集作用,产生辉铜矿(Cu2S)与铜蓝(CuS).
已知:Cu2S、CuS是两种不溶于水的黑色固体,在一定条件下都能与稀HNO3反应:
①3CuS+8H++8NO3-→3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-→6Cu2++3SO42-+10NO↑+8H2O
现将四份质量不同的某Cu2S和CuS混合物样品分别和100mL物质的量为5mol/L的稀硝酸充分反应,所取样品质量与产生气体体积.(标准状况测定)如表所示:
试回答下列问题(不考虑硝酸的挥发以及溶液体积变化):
(1)a实验结束后,溶液中c(NO3-)=2.75mol/L.
(2)b实验结束后,溶液的pH=0.
已知:Cu2S、CuS是两种不溶于水的黑色固体,在一定条件下都能与稀HNO3反应:
①3CuS+8H++8NO3-→3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-→6Cu2++3SO42-+10NO↑+8H2O
现将四份质量不同的某Cu2S和CuS混合物样品分别和100mL物质的量为5mol/L的稀硝酸充分反应,所取样品质量与产生气体体积.(标准状况测定)如表所示:
| 实验编号 | a | b | c |
| 样品质量(g) | 9.6 | 12.8 | 64.0 |
| 气体体积(L) | 5.04 | 6.72 | V |
(1)a实验结束后,溶液中c(NO3-)=2.75mol/L.
(2)b实验结束后,溶液的pH=0.
11.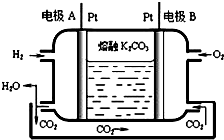 运用所学化学原理,解决下列问题:
运用所学化学原理,解决下列问题:
(1)氰化物多数易溶于水,有剧毒,其中HCN是易挥发的弱酸,已知:Ka(HCN)=6.17x10-10.处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),c(CN-)<c(HCN)(填“>”、“<”或“=”).
(2)已知:
①C(s)+O2(g)═CO2(g);△H=a kJ•mol-1;
②CO2(g)+C(s)═2CO(g);△H=b kJ•mol-1;
③Si(s)+O2(g)═SiO2(s);△H=c kJ•mol-1.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)═Si(s)+2CO(g)△H=(a+b-c)kJ•mol-1.
(3)已知:CO(g)+H2O(g)?H2(g)+CO2(g).下表为该反应在不同温度时的平衡常数.
该反应的△H<0(填“>”、“<”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为75%.
(7)一种新型氢氧燃料电池工作原理如图所示.写出电极A的电极反应式H2-2e-+CO32-═CO2+H2O.
 运用所学化学原理,解决下列问题:
运用所学化学原理,解决下列问题:(1)氰化物多数易溶于水,有剧毒,其中HCN是易挥发的弱酸,已知:Ka(HCN)=6.17x10-10.处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),c(CN-)<c(HCN)(填“>”、“<”或“=”).
(2)已知:
①C(s)+O2(g)═CO2(g);△H=a kJ•mol-1;
②CO2(g)+C(s)═2CO(g);△H=b kJ•mol-1;
③Si(s)+O2(g)═SiO2(s);△H=c kJ•mol-1.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)═Si(s)+2CO(g)△H=(a+b-c)kJ•mol-1.
(3)已知:CO(g)+H2O(g)?H2(g)+CO2(g).下表为该反应在不同温度时的平衡常数.
| 温度/ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(7)一种新型氢氧燃料电池工作原理如图所示.写出电极A的电极反应式H2-2e-+CO32-═CO2+H2O.
 1,2一二氯乙烯有如图两种结构.
1,2一二氯乙烯有如图两种结构. 某研究小组探究:
某研究小组探究: