题目内容
【题目】有人曾建议用AG表示溶液的酸度,AG的定义为AG=lg![]() 。下列表述正确的是( )
。下列表述正确的是( )
A. 在25℃时,溶液的pH与AG的换算公式为AG=14+pH
B. 在25℃时,若溶液呈酸性,则pH<7,AG<0
C. 在25℃时,若溶液呈碱性,则pH>7,AG<0
D. 在25℃时,若溶液呈中性,则pH=7,AG=1
【答案】C
【解析】从pH与AG的定义式中寻找c(H+)与c(OH-)的相对大小与溶液的酸碱性的关系。A、在25℃时,溶液的pH与AG的换算公式为AG=lg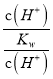 =lg
=lg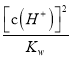 =14+2lg
=14+2lg![]() =2×(7-pH),选项A错误; B、在25℃时,酸性溶液中c(H+)> c(OH-),即c(H+)>10-7mol/L,则pH<7;又
=2×(7-pH),选项A错误; B、在25℃时,酸性溶液中c(H+)> c(OH-),即c(H+)>10-7mol/L,则pH<7;又 >1,则AG>0,选项B错误;C、在25℃时,碱性溶液中c(H+)< c(OH-),即c(OH-)>10-7mol/L,则pH>7;又
>1,则AG>0,选项B错误;C、在25℃时,碱性溶液中c(H+)< c(OH-),即c(OH-)>10-7mol/L,则pH>7;又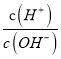 <1,则AG<0,选项C正确;D、在25℃时,中性溶液中c(H+)= c(OH-),则pH=7,因
<1,则AG<0,选项C正确;D、在25℃时,中性溶液中c(H+)= c(OH-),则pH=7,因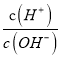 =1,AG=lg1=0,选项D错误。答案选择C。
=1,AG=lg1=0,选项D错误。答案选择C。

 阅读快车系列答案
阅读快车系列答案【题目】消毒剂在生产、生活中有重要的作用,常见的含氯消毒剂有NaClO2、NaClO、ClO2 和Cl2
回答下列问题:
(1)NaClO2所含的化学键类型有________________。
(2)消毒剂投入水中,一段时间后与氨结合得到一种结合性氯胺(NH2Cl)。NH2Cl 在中性或酸性条件下也是一种强杀菌消毒剂,常用于城市自来水消毒。其理由是________________(用化学方程式表示)。
(3) “有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是每克含氯消毒剂的氧化能力相当于多少克Cl2 的氧化能力。上述四种含氯消毒剂中消毒能力最强的是________________。
(4)自来水厂用ClO2 处理后的水中,要求ClO2 的浓度在0.1~0.8 mg·L-1之间。用碘量法检测ClO2 处理后的自来水中ClO2 浓度的实验步骤如下:
步骤Ⅰ.取一定体积的水样,加入足量碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。
步骤Ⅱ.用Na2S2O3 溶液滴定步骤Ⅰ中所得的溶液。
已知:a. 操作时,不同pH 环境中粒子种类如下表所示。
pH | 2 | 7 |
粒子种类 | Cl- | ClO2- |
b. 2S2O32-+I2==S4O62-+2I-。
①步骤Ⅱ中反应结束时溶液呈___________(填“蓝色”或“无色”)
②若水样的体积为1.0L,在步骤Ⅱ中消耗10mL1.0×10-3mol·L-1Na2S2O3 溶液,则该水样中c(ClO2)=___________mg·L-1
【题目】室温下,下列有关两种溶液的说法不正确的是
序号 | ① | ② |
pH | 12 | 12 |
溶液 | 氨水 | 氢氧化钠溶液 |
A.①②两溶液中c(OH-)相等
B.①溶液的物质的量浓度为0.01mol·L-1
C.①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>②
D.等体积的①②两溶液分别与0.01 mol·L-1的盐酸完全中和,消耗盐酸的体积:①>②

