��Ŀ����
����Ŀ����ͼ��һ����ѧ���̵�ʾ��ͼ���ش��������⣺
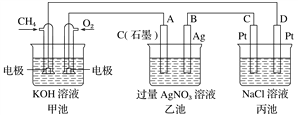
��1���׳���_________װ�ã���װ���е缫A��������_____________��
��2����װ����ͨ��O2�ĵ缫��ӦʽΪ______________________����װ���е缫B(Ag)�ĵ缫��ӦʽΪ_____________________����װ����D���IJ�����____________(д��ѧʽ)��
��3��һ��ʱ�䣬�������в������干112 mL(��״��)ʱ�����Ƚ�����أ�������Һ��pH��_____(�¶�Ϊ25 ��ʱ������֪NaCl��Һ���������������ɵ���������Һ�е��ܽ�ͷ�Ӧ��������Һ���Ϊ500 mL)��
���𰸡� ԭ��� ���� O2+4e-+2H2O=4OH- Ag++e-=Ag H2 12
����������1���׳��м�������ԭ�����ǵ�صĸ������׳���ԭ���װ�ã���װ���е缫A��ԭ��ص�����������A����������������2����װ����ͨ��O2�ĵ缫��ԭ��ص���������ӦʽΪO2+4e-+2H2O=4OH-����װ���е缫B(Ag)�ǵ��ص��������缫��ӦʽΪ Ag++e-=Ag����װ����D���ǵ���������H���õ���������������װ����D���IJ�����H2����3��������������Ƶ����ʵ���Ũ����xmol��L��1�������в���112mL��������������������������ͬ��Ϊ56ml��
2NaCl+2H2O![]() H2��+Cl2��+2NaOH
H2��+Cl2��+2NaOH
22.4L 2mol
0.056L 0.5xmol
��x=![]() =0.01mol��L��1����C��H����=10-12 mol��L��1��������Һ��pH=12��
=0.01mol��L��1����C��H����=10-12 mol��L��1��������Һ��pH=12��