题目内容
【题目】锌是一种重要的过渡金属,锌及其化合物有着广泛的应用。
(1)指出锌在周期表中的位置:第________周期,第________族,________区。
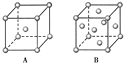
(2)Zn形成金属晶体,其金属原子堆积属于下列______模式。
A.简单立方 B.钾型 C.镁型 D.铜型
(3)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式________;葡萄糖分子中碳原子的杂化方式为________。
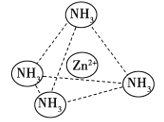
(4)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于________(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,NH3位于正四面体的顶点,试在右下图中表示[Zn(NH3)4]2+中Zn2+与NH3之间的化学键______。
(5)下图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为______________________。该化合物晶体的熔点比干冰高得多,原因是____________________。

(6)与锌同周期,最外层有3个未成对电子的元素名称是________,该元素最高价氧化物对应水化物的酸性比溴的最高价氧化物对应水化物的酸性________(填“强”或“弱”)。
【答案】 四 ⅡB ds C 1s22s22p63s23p63d10或[Ar]3d10 sp2、sp3 极性分子 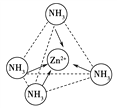 ZnX 该化合物是原子晶体,而干冰是分子晶体 砷 弱
ZnX 该化合物是原子晶体,而干冰是分子晶体 砷 弱
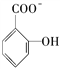
【解析】(1)锌是30号元素,位于第四周期、第ⅡB族,其价电子排布式为3d104s2,所以属于ds区;(2)锌原子堆积属于六方最密堆积,答案选C;(3)Zn失去最外层2个电子形成Zn2+,Zn2+基态电子排布式为1s22s22p63s23p63d10或[Ar]3d10;葡萄糖分子中,饱和碳原子以sp3形式杂化,![]() 中的碳原子以sp2形式杂化。(4)NH3分子呈三角锥形,是极性分子。在[Zn(NH3)4]2+中,Zn2+与NH3之间存在配位键,即
中的碳原子以sp2形式杂化。(4)NH3分子呈三角锥形,是极性分子。在[Zn(NH3)4]2+中,Zn2+与NH3之间存在配位键,即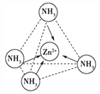 。(5)锌与X元素形成的化合物的晶胞中,N(X):N(Zn)=(8×1/8+6×1/2):4=1:1,所以该化合物的化学式为ZnX。由于该化合物形成的晶体是原子晶体,熔点比干冰(分子晶体)高很多。(6)与锌同周期,最外层有3个未成对电子的元素名称是砷,同周期自左向右非金属性逐渐增强,因此砷元素最高价氧化物对应水化物的酸性比溴的最高价氧化物对应水化物的酸性弱。
。(5)锌与X元素形成的化合物的晶胞中,N(X):N(Zn)=(8×1/8+6×1/2):4=1:1,所以该化合物的化学式为ZnX。由于该化合物形成的晶体是原子晶体,熔点比干冰(分子晶体)高很多。(6)与锌同周期,最外层有3个未成对电子的元素名称是砷,同周期自左向右非金属性逐渐增强,因此砷元素最高价氧化物对应水化物的酸性比溴的最高价氧化物对应水化物的酸性弱。