题目内容
【题目】已知温度T时水的离子积常数为Kw,该温度下,将浓度为amol/L的一元酸HA与bmol/L的一元碱BOH等体积混合,可判断该溶液呈中性的依据是:
A. a=b
B. 混合溶液的pH值为7
C. 混合溶液中C(H+)=![]()
D. 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
【答案】C
【解析】试题分析:A、不清楚酸和碱是否是强电解质,如果两者是强电解质,溶液呈现中性,即a=b,如果属于弱电解质,则a≠b,故错误;B、没有说明温度,如果温度是100℃,此时溶液显碱性,故错误;C、溶液显中性,说明c(H+)=c(OH-),根据水的离子积,因此有:c(H+)=![]() ,故正确;D、此关系式是溶液显电中性,不是呈中性,故错误。
,故正确;D、此关系式是溶液显电中性,不是呈中性,故错误。

 阅读快车系列答案
阅读快车系列答案【题目】【江西省景德镇市2017届高三第二次模拟理综化学试题】(1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);△H<0。CO和H2O浓度变化如图,则04 min的平均反应速率v(CO)=______________ mol/(L·min)
CO2(g)+H2(g);△H<0。CO和H2O浓度变化如图,则04 min的平均反应速率v(CO)=______________ mol/(L·min)
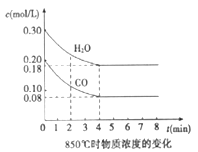
(2)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表。
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c4 |
4 | c1 | c2 | c3 | c4 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
请回答:
①表中34 min之间反应处于_____________状态;c3数值_____________0.12 mol/L(填大于、小于或等于)。
②反应在45 min间,平衡向逆方向移动,可能的原因是_____________(单选),表中56 min之间数值发生变化,可能的原因是_____________(单选)。
a.增加了水蒸气的量 b.升高温度 c.使用催化剂 d.增加压强
(3)如图是一个电化学的装置图。
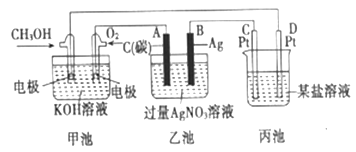
①图中乙池是________装置(填“电解池”或“原电池”)甲池中OH-移向____________极(填“CH3OH”或“O2”)。若丙池中为400ml 1mol/L硫酸铜溶液,当外电路有1mol电子通过时,C、D两极共产生_______mol的气体。
②写出B电极的电极反应式:_______________________________________。