题目内容
【题目】(1)依据第2周期元素第一电离能的变化规律,参照下图中B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置_______。

(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2![]() NF3+3NH4F。基态铜原子的核外电子排布式为________。
NF3+3NH4F。基态铜原子的核外电子排布式为________。
(3)BF3与一定量的水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

①晶体Q中各种微粒间的作用力不涉及________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为________,阴离子的中心原子轨道采用________杂化。
(4)已知苯酚![]() 具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子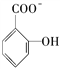 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酸)(填“>”或“<”),其原因是______________________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酸)(填“>”或“<”),其原因是______________________。
【答案】  1s22s22p63s23p63d104s1或[Ar]3d104s1 a、d 三角锥形 sp3 <
1s22s22p63s23p63d104s1或[Ar]3d104s1 a、d 三角锥形 sp3 < ![]() 中形成分子内氢键,使其更难电离出H+
中形成分子内氢键,使其更难电离出H+
【解析】(1)第2周期从左向右元素的第一电离能呈增大趋势,但氮元素因为p能级电子为半充满状态,其第一电离能大于氧。(2)铜的原子序数是29,基态铜原子的核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1。(3)①由Q的结构式可知H2O和BF3·H2O之间有氢键,BF3·H2O分子内有共价键和配位键,分子之间存在范德华力,故Q中不存在离子键和金属键,答案选ad。②R为离子晶体,阳离子为[H3O]+,中心原子氧原子价层电子对数=3+(61×31)/2=4,孤电子对=(61×31)/2=1,空间构型为三角锥形;阴离子为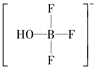 ,阴离子中中心原子B原子含有4个σ键且不含孤电子对,所以B原子采用sp3杂化。(4)由于
,阴离子中中心原子B原子含有4个σ键且不含孤电子对,所以B原子采用sp3杂化。(4)由于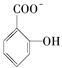 能形成分子内氢键,所以水杨酸的第二级电离更困难,故Ka2(水杨酸)<Ka(苯酚)。
能形成分子内氢键,所以水杨酸的第二级电离更困难,故Ka2(水杨酸)<Ka(苯酚)。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】锗是一种重要的半导体材料。工业上用精硫锗矿(主要成分为GeS2,杂质不反应)制取Ge,其工艺流程如图所示:

回答下列问题:
(1)开始将精硫锗矿粉碎的目的是______。
(2)高温焙烧精硫锗矿的化学方程式为______。
(3)热还原真空挥发炉内反应的化学方程式为______。
(4)在沉锗过程中,当温度为90℃,pH为14时,加料量(CaCl2/Ge质量比)对沉锗的影响如表所示,选择最佳加料量为______(填“10-15”“15-20”或“20-25”),理由是______。
编号 | 加料量(CaCl2/Ge) | 母液体积 (mL) | 过滤后液含锗(mg/L) | 过滤后液 pH | 锗沉淀率(%) |
1 | 10 | 500 | 76 | 8 | 93.67 |
2 | 15 | 500 | 20 | 8 | 98.15 |
3 | 20 | 500 | 2 | 11 | 99.78 |
4 | 25 | 500 | 1.5 | 12 | 99.85 |
(5)某温度时,沉锗得到的CaGeO3在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是______。

a.n点与p点对应的Ksp相等
b.通过蒸发可以使溶液由q点变到p点
c.q点无CaGeO3沉淀生成
d.加入Na2GeO3可以使溶液由n点变到m点
(6)CaGeO3与强酸反应可得到H2GeO3。0.l molL-1的NaHGeO3溶液pH_____(填“>”“=”或“<”)7,判断理由是______(通过计算比较)。(25℃时,H2GeO3的Ka1=1.7×10-9,Ka2=1.9×10-13。)
【题目】氯化苄(C6H5CH2Cl)为无色液体,是一种重要的有机化工原料。现在实验室模拟工业上用甲苯与干燥氯气在光照条件下加热反应合成氯化苄、分离出氯化苄并检验样品的纯度,其装置(夹持装置略去)如图所示:
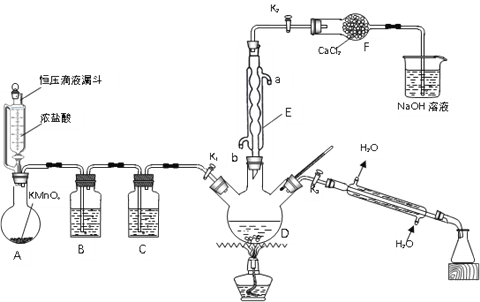
回答下列问题:
(1)仪器E的名称是______;其作用是______;其进水口为______(填“a”或“b”)。
(2)装置B中的溶液为______;装置F的作用是______。
(3)用恒压滴液漏斗代替分液漏斗的优点是______。
(4)装置A中反应的离子方程式为______。
(5)反应结束后,关闭K1和K2,打开K3,加热三颈烧瓶,分馏出氯化苄,应选择温度范围为______℃。
物质 | 溶解性 | 熔点(℃) | 沸点(℃) |
甲苯 | 极微溶于水,能与乙醇、乙醚等混溶 | -94.9 | 110 |
氯化苄 | 微溶于水,易溶于苯、甲苯等有机溶剂 | -39 | 178.8 |
二氯化苄 | 不溶于水,溶于乙醇、乙醚 | -16 | 205 |
三氯化苄 | 不溶于水,溶于乙醇、乙醚和苯 | -7 | 220 |
(6)检测氯化苄样品的纯度:
①称取13.00g样品于烧杯中,加入50.00mL 4 molL-1 NaOH水溶液,水浴加热1小时,冷却后加入35.00mL 40% HNO3,再将全部溶液转移到容量瓶中配成100mL溶液。取20.00mL溶液于试管中,加入足量的AgNO3溶液,充分振荡,过滤、洗涤、干燥,称量固体质量为2.87g,则该样品的纯度为______%(结果保留小数点后1位)。
②实际测量结果可能偏高,原因是______。