题目内容
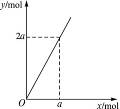
将22.4 g铁粉逐渐加入到含HNO3 0.8 mol的稀硝酸中,反应生成的气体的物质的量(x)随消耗铁粉的物质的?量(?y?)?变化关系如图,正确的是( )?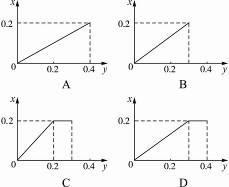

C?
Fe与稀硝酸反应n(Fe)="22.4" g56 g·mol-1="0.4" mol,设稀HNO3完全反应,消耗Fe x mol,设生成Fe(NO3)3y mol?
Fe+4HNO3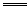 Fe(NO3)3+NO↑+2H2O?
Fe(NO3)3+NO↑+2H2O?
1 4 1?
X 0.8 y y=0.2?
x="0.2" mol?
Fe过量(0.4-0.2)="0.2" mol?
继续加入Fe粉,不再产生NO气体,过量的铁与Fe(NO3)3发生反应,Fe+2Fe(NO3)33Fe(NO3)2
1 2?
0.1 0.2?
完全反应还只需加0.1 mol Fe
通过以上分析,选C。
Fe+4HNO3
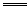 Fe(NO3)3+NO↑+2H2O?
Fe(NO3)3+NO↑+2H2O?1 4 1?
X 0.8 y y=0.2?
x="0.2" mol?
Fe过量(0.4-0.2)="0.2" mol?
继续加入Fe粉,不再产生NO气体,过量的铁与Fe(NO3)3发生反应,Fe+2Fe(NO3)33Fe(NO3)2
1 2?
0.1 0.2?
完全反应还只需加0.1 mol Fe
通过以上分析,选C。

练习册系列答案
相关题目
 标准状况下每产生448L二氧化碳时,纯碱溶液增重880 g。
标准状况下每产生448L二氧化碳时,纯碱溶液增重880 g。