题目内容
锌与不同浓度的硝酸反应,HNO3可以被还原成不同价态的产物。下列化学反应中参加反应的锌与被还原的HNO3的物质的量的关系符合图1-12(x表示被还原的HNO3的物质的量,y表示耗去Zn的物质的量)的是( )
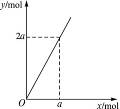
图1-12

图1-12
| A.3Zn+8HNO3(稀)====3Zn(NO3)2+2NO↑+4H2O |
| B.4Zn+10HNO3(极稀) ====4Zn(NO3)2+NH4NO3+3H2O |
| C.4Zn+10HNO3(很稀) ====4Zn(NO3)2+N2O↑+5H2O |
| D.Zn+4HNO3(浓) ====Zn(NO3)2+NO2↑+2H2O |
C
由图知:若2 molZn参加反应,作还原剂,被还原的HNO3则是1 mol;若4 mol Zn参加反应,被还原的HNO3是2 mol,即生成1 mol N2O。

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目