题目内容
【题目】PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生反应:PCl3(g)+Cl2(g)![]() PCl5(g),并于10min时达到平衡。有关数据如下:
PCl5(g),并于10min时达到平衡。有关数据如下:
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度(mol·L-1) | 2.0 | 1.0 | 0 |
平衡浓度(mol·L-1) | c1 | c2 | 0.4 |
下列判断不正确的是
A.10min内,v(Cl2)=0.04mol·L-1·min-1
B.当容器中Cl2为1.2mol时,反应达到平衡
C.升高温度(T1<T2),反应的平衡常数减小,平衡时PCl3的![]() <1
<1
D.平衡后移走2.0molPCl3和1.0molCl2,相同条件下再次平衡,c(PCl5)<0.2mol·L-1
【答案】C
【解析】
A.根据表格数据可知平衡时△c(PCl5)=0.4mol/L,则v(PCl5)=![]() =0.04mol·L-1·min-1,根据反应方程式可知v(Cl2)=v(PCl5)=0.04mol·L-1·min-1,故A正确;
=0.04mol·L-1·min-1,根据反应方程式可知v(Cl2)=v(PCl5)=0.04mol·L-1·min-1,故A正确;
B.平衡时△c(PCl5)=0.4mol/L,根据反应方程式可知△c(Cl2)=0.4mol/L,则平衡时c(Cl2)=1.0mol/L-0.4mol/L=0.6mol/L,容器体积为2L,所以平衡时n(Cl2)=1.2mol,故B正确;
C.升高温度平衡常数减小,说明升高温度平衡逆向移动,则n(PCl3)增大,所以平衡时PCl3的![]() <1,则
<1,则![]() >1,故C错误;
>1,故C错误;
D.若平衡后移走2.0molPCl3和1.0molCl2,再次达到平衡时与原平衡为等效平衡,则c(PCl5)=0.2mol·L-1,但实际上压强减小,平衡逆向移动,所以c(PCl5)<0.2mol·L-1,故D正确;
故答案为C。

【题目】中学化学中很多“规律”都有适用范围,下列根据有关“规律”推出的结论正确的是( )
选项 | 规律 | 结论 |
A | 元素的非金属性较强,其单质也越活泼 | 磷单质比 |
B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓硝酸、稀硝酸,浓硝酸中铝片先溶解完全 |
C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 |
|
D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加 |
A.AB.BC.CD.D
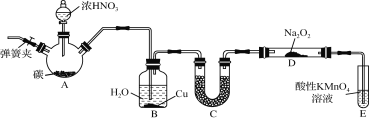
【题目】从某含Br-废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。
已知:①2NaOH+Cl2==NaCl+NaClO+H2O
②Br2极易溶于四氯化碳和正十二烷
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
在水中溶解性 | 微溶 | 难溶 | 难溶 |

下列说法不正确的是
A. 甲装置中Br-发生的反应为:2Br-+Cl2===Br2+2Cl-
B. 甲装置中NaOH溶液每吸收1个Cl2,转移1个e-
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2