题目内容
【题目】(1)在化学反应中使普通分子变成活化分子所需提供的最低能量叫活化能,观察如图,然后回答问题。
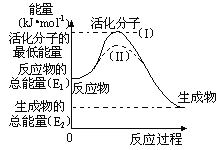
①图中反应是___(填“吸热”或“放热”),该反应的△H=___(用含E1、E2的代数式表示)。
②已知热化学方程式:H2(g)+![]() O2(g)=H2O(g) △H=-241.8kJmol-1,该反应的活化能为167.2kJmol-1,则其逆反应的活化能为___。
O2(g)=H2O(g) △H=-241.8kJmol-1,该反应的活化能为167.2kJmol-1,则其逆反应的活化能为___。
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.0kJ的热量。
①反应的热化学方程式为___。
②又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出热量是___kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是___。
【答案】放热 E2-E1 409.0kJ/mol N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) △H=-640kJ/mol 408kJ 产物为氮气和水,清洁无污染
【解析】
(1)①依据图象,反应物的能量大于生成物的能量;反应的焓变=生成物的能量-反应物的能量;②逆反应的活化能=正反应的活化能+反应的焓变;
(2)①0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.0kJ的热量,1mol液态肼和过氧化氢反应放热640.0 kJ,据此书写热化学方程式;②依据盖斯定律分析计算N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(l)的焓变,再计算16g液态肼与液态双氧水反应生成液态水时放出的热量;③燃烧产物无污染是其优点。
(1)①依据图象可知,反应物的能量大于生成物的能量,为放热反应;反应的焓变=生成物的总能量-反应物的总能量,即△H=(E2-E1)kJmol-1,故答案为:放热;(E2-E1)kJmol-1;
②反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变;H2(g)+![]() O2(g)═H2O(g) △H=-241.8kJmol-1,该反应的活化能为167.2kJmol-1,则其逆反应的活化能=167.2kJ/mol+241.8kJ/mol=409.0kJ/mol,故答案为:409.0kJ/mol;
O2(g)═H2O(g) △H=-241.8kJmol-1,该反应的活化能为167.2kJmol-1,则其逆反应的活化能=167.2kJ/mol+241.8kJ/mol=409.0kJ/mol,故答案为:409.0kJ/mol;
(2)①0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.0kJ的热量,1mol液态肼和过氧化氢反应放热640.0 kJ,反应的热化学方程式为:N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(g) △H=-640.0 kJ/mol,故答案为:N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(g) △H=-640.0 kJ/mol;
②a.N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(g)△H=-640.0 kJ/mol,b.H2O(l)=H2O(g) △H=+44kJ/mol,依据盖斯定律a-b×4得到:N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(l) △H=-816.0kJ/mol,依据热化学方程式可知32g肼反应放热816.0kJ,则16g液态肼与液态双氧水反应生成液态水时放出的热量是408.0kJ,故答案为:408.0;
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,生成物为氮气和水,不污染空气,故答案为:生成物为氮气和水,不污染空气。

【题目】PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生反应:PCl3(g)+Cl2(g)![]() PCl5(g),并于10min时达到平衡。有关数据如下:
PCl5(g),并于10min时达到平衡。有关数据如下:
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度(mol·L-1) | 2.0 | 1.0 | 0 |
平衡浓度(mol·L-1) | c1 | c2 | 0.4 |
下列判断不正确的是
A.10min内,v(Cl2)=0.04mol·L-1·min-1
B.当容器中Cl2为1.2mol时,反应达到平衡
C.升高温度(T1<T2),反应的平衡常数减小,平衡时PCl3的![]() <1
<1
D.平衡后移走2.0molPCl3和1.0molCl2,相同条件下再次平衡,c(PCl5)<0.2mol·L-1
【题目】探究![]() 反应的速率影响因素,设计了以下实验。下列说法正确的是
反应的速率影响因素,设计了以下实验。下列说法正确的是
锥形瓶标号 |
| 蒸馏水 |
| 反应温度 | 浑浊出现时间 | 备注 |
1 |
| 0 mL | 10 mL |
| 10s | |
2 | 10mL | 5mL | 5 mL |
| 16 s | |
3 | 10mL | 0mL | 10 mL |
| 5 s | 第10s开始浑浊不再增多 |
4 | 10mL | 6mL | 4mL |
| 8s |
A.该反应也可通过测![]() 的体积变化来表示化学反应速率的快慢
的体积变化来表示化学反应速率的快慢
B.3号瓶用![]() 来表示速率为
来表示速率为![]()
C.由2号瓶和3号瓶实验结果可得温度越高反应速率越快
D.由1号瓶和4号瓶实验结果可得温度越高反应速率越快