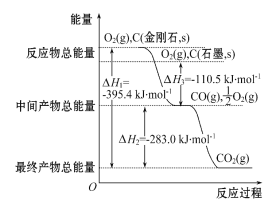
题目内容
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)基态Ga原子的核外电子排布式为[Ar]____。
(2)根据元素周期律,元素的电负性Ga____(填“大于”或“小于”,下同)As,第一电离能B____Ga;BF3和NH3的分子能够通过配位键相结合的原因是____。
(3)杀虫剂Na3AsO4中阴离子的空间构型为____,As原子采取____杂化。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是____。
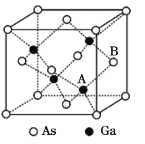
(5)原子晶体GaAs的晶胞参数a=x pm,它的晶胞结构如下图所示。该晶胞内部存在的共价键数为____;该晶体的密度为______g/cm3(阿伏加德罗常数的值用NA表示)。
【答案】3d104s24p1 小于 大于 NH3中的N具有孤对电子,BF3中的B核外具有空轨道 正四面体 sp3 GaF3是离子晶体,GaCl3是分子晶体,离子晶体GaF3的熔沸点高 16 ![]()
【解析】
(1)Ga是31号元素,位于元素周期表第四周期第ⅢA,则基态Ga原子的核外电子排布式是[Ar]3d104s24p1;
(2)同一周期的元素,原子序数越大,元素的非金属性越强。元素的非金属性Ga<As,所以元素的电负性Ga<As;同一主族的元素,原子序数越大,元素的原子半径越大,原子失去电子就越容易,其第一电离能就越小,由于元素的非金属性B>Ga,所以第一电离能B>Ga;BF3和NH3的分子能够通过配位键相结合,是由于NH3中N提供孤电子对,BF3中B提供空轨道;
(3)杀虫剂Na3AsO4中阴离子为AsO43-,根据VSEPR理论,价电子对数VP=4+![]() =4,则其空间构型为正四面体;根据杂化轨道理论,中心As的杂化方式为sp3杂化;
=4,则其空间构型为正四面体;根据杂化轨道理论,中心As的杂化方式为sp3杂化;
(4)组成相似的GaF3和GaCl3晶体,前者属于离子晶体,后者属于分子晶体,离子键比分子间作用力大得多,所以前者的熔沸点比后者高;
(5)一个Ga与周围4个As形成共价键,所以晶胞内存在共价健数为4×4=16;在一个晶胞中含有的As原子个数为8×![]() +6×
+6×![]() =4,含有的Ga原子个数为4个,则1mol晶胞的质量m=4×145g=580g,1个晶胞的体积为V=a3pm3=(x×10-10)3cm3,所以晶体密度为ρ=
=4,含有的Ga原子个数为4个,则1mol晶胞的质量m=4×145g=580g,1个晶胞的体积为V=a3pm3=(x×10-10)3cm3,所以晶体密度为ρ=![]() g/cm3=
g/cm3=![]() g/cm3。
g/cm3。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案