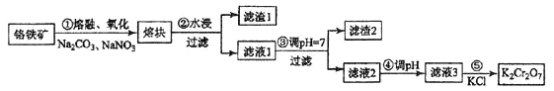
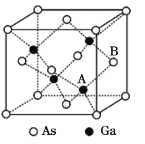
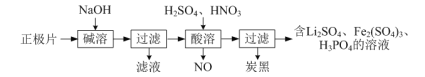
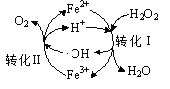
题目内容
【题目】下列有关说法正确的是( )
①室温下,向AgCl浊液中加入少量NaCl饱和溶液,则c(Ag+)、Ksp(AgCl)均减小
②在![]() =1012溶液中 Na+、I-、NO3-、SO42-不能大量共存
=1012溶液中 Na+、I-、NO3-、SO42-不能大量共存
③在原电池装置中,电子从负极流出,沿导线流入正极,经溶液或盐桥回到负极
④锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
⑤高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
⑥用0.1 mol/LCH3COOH溶液滴定0.1 mol/LNaOH溶液至中性时:c(CH3COO-)+c(CH3COOH)>c(Na+)
⑦100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性
⑧向饱和NaC1溶液中先通入足量CO2,再通入足量NH3,可析出NaHCO3晶体
A.②④⑥B.①②⑦C.①④⑤D.③⑤⑧
【答案】A
【解析】
①确定物质的溶度积常数只与温度有关,温度不变,溶度积不变,①错误;
② =1012溶液呈酸性,I-具有还原性,NO3-在酸性溶液中具有强氧化性,H+、I-、NO3-会发生氧化还原反应,不能大量共存,②正确;
=1012溶液呈酸性,I-具有还原性,NO3-在酸性溶液中具有强氧化性,H+、I-、NO3-会发生氧化还原反应,不能大量共存,②正确;
③在原电池装置中,电子从负极流出,沿导线流入正极,溶液中的阳离子在正极得到电子,溶液中的阴离子流向正极,构成闭合回路,③错误;
④锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理得到CaCO3,形成沉淀的转化,然后用稀盐酸除去,④正确;
⑤二氧化硅广泛用于制作光导纤维,不是硅单质,⑤错误;
⑥用0.1 mol/LCH3COOH溶液滴定0.1 mol/LNaOH溶液至中性时:由于c(OH-)=c(H+),且c(CH3COO-)+ c(OH-)=c(Na+)+c(H+),故c(CH3COO-)=c(Na+),则c(CH3COO-)+ c(OH-)=c(Na+)+c(CH3COOH)>c(Na+),⑥正确;
⑦100℃时,水的离子积Kw=l0-12,故pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显碱性,⑦错误;
⑧向饱和NaC1溶液中先通入足量NH3,再通入足量CO2,可析出NaHCO3晶体,⑧错误;
综上分析,正确的是:②④⑥,故合理选项是A。

 每课必练系列答案
每课必练系列答案【题目】将0.8 mol I2(g)和1.2 mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) ![]() 2HI(g) ΔH <0并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g) ΔH <0并达到平衡。HI的体积分数随时间的变化如表格所示:
HI体积分数 | 1min | 2min | 3min | 4min | 5min | 6min | 7min |
条件I | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
条件II | 20% | 33% | 43% | 52% | 57% | 65% | 65% |
下列说法中正确的是
A. 在条件I下,该反应的平衡常数K=10
B. 在条件I下,从开始反应至5min,用H2表示的反应速率为0.10 mol/(L·min)
C. 在条件II下,到达平衡时, I2(g)的转化率为81.25%
D. 与条件I相比,为达到条件II的数据,可能改变的条件是降低压强