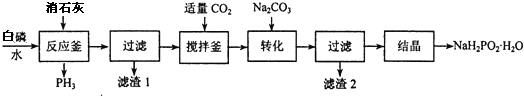
题目内容
8.铝热反应生成的铁常因其中含有铝而形成合金.一定质量的铁铝合金溶于足量的NaOH溶液中,完全反应后产生6.72L(标准状况下)气体;用同样质量的铁铝合金完全溶于足量的盐酸中,在标准状况下产生17.92L气体.则该合金中铝、铁的物质的量之比为( )| A. | 1:1 | B. | 2:5 | C. | 3:2 | D. | 3:5 |
分析 合金中只有Al和NaOH反应生成氢气,根据转移电子相等计算Al的物质的量;Al能和NaOH、HCl反应生成氢气,只要Al的质量一定,则Al和足量NaOH、HCl反应生成氢气的量相同,根据转移电子守恒计算Fe的物质的量,据此分析解答.
解答 解:合金中只有Al和NaOH反应生成氢气,和NaOH反应生成n(H2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,根据转移电子相等得n(Al)=$\frac{0.3mol×2}{3}$=0.2mol;Al能和NaOH、HCl反应生成氢气,只要Al的质量一定,则Al和足量NaOH、HCl反应生成氢气的量相同,所以Al与足量盐酸反应生成氢气的物质的量是0.3mol,则Fe与盐酸反应生成$\frac{17.92L}{22.4L/mol}$=0.8mol-0.3mol=0.5mol,根据转移电子守恒得n(Fe)=$\frac{0.5mol×2}{2}$=0.5mol,
所以合金中Al、Fe的物质的量之比=0.2mol:0.5mol=2:5,故选B.
点评 本题考查混合物的有关计算,为高频考点,明确物质之间发生的反应是解本题关键,利用转移电子守恒进行分析解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.高温下,某反应达到平衡,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
| A. | 该反应是焓变为负值 | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应化学方程式为CO2(g)+H2(g) $?_{高温}^{催化剂}$ CO(g)+H2O(g) |
16.下列关于苯的叙述中错误的是( )
| A. | 苯的硝化反应是取代反应 | |
| B. | 在苯中加入酸性KMnO4溶液,振荡并静置后下层液体为紫色 | |
| C. | 78g苯(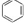 )中含有C=C双键的数目为3NA )中含有C=C双键的数目为3NA | |
| D. | 在一定条件下,苯能与氢气发生加成反应 |
3.化学与生活密切相关,下列有关说法错误的是( )
| A. | 在人体内,油脂的主要反应是在脂肪酶催化下水解为高级脂肪酸和甘油 | |
| B. | 鉴别蚕丝和人造丝(纤维素)的方法之一是灼烧,有烧焦羽毛气味的是蚕丝 | |
| C. | 农村兴建沼气池将秸秆发酵产生沼气,可减少因焚烧带来的环境污染 | |
| D. | 氮、磷是作物生长的重要元素,故含氮、磷的废水可直接排放到湖泊中 |
13.下列有关催化剂的说法错误的是( )
| A. | 降低了化学反应的焓变 | |
| B. | 催化剂能同等程度地加快正逆反应速率 | |
| C. | 降低了反应所需的活化能 | |
| D. | 酶具有高度的催化活性和专一性 |
20.在溶液中进行的化学反应Ag++Fe2+?Ag(s)+Fe3+ (正反应放热),为使平衡体系析出更多的银,可采取的措施是( )
| A. | 移去一些析出的银 | B. | 增加Fe2+的浓度 | ||
| C. | 升高溶液的温度 | D. | 常温下加压 |
17.在0.1mol•L-1的CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述正确的是( )
| A. | 加入少量NaOH固体,平衡正向移动,溶液中c(H+)增大 | |
| B. | 加水,平衡正向移动,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$减小 | |
| C. | 通入少量HCl,平衡逆向移动,溶液中c(H+)减少 | |
| D. | 加入少量CH3COONa固体,平衡逆向移动,溶液导电能力减弱 |