题目内容
(12分)Ⅰ、氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用。回答下列问题:(1)氮元素原子的L层电子数为__________;
(2) NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为_________________________;
(3) 肼-空气燃料电池是一种碱性电池,该电池放电时,正极的反应式为________________________________。
Ⅱ、一定质量的液态化合物XY2在标准状况下的一定质量的O2中恰好完全燃烧,反应方程式为: XY2(l)+3O2 (g) ="==" XO2(g)+2YO2 (g)冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56g/L则: (1)反应前O2的体积是________。(2)化合物XY2的摩尔质量是___________。
(3)XY2分子中X、Y两元素质量比是3∶16, X、Y两元素分别为__________ (写元素符号)。
(2) NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为_________________________;
(3) 肼-空气燃料电池是一种碱性电池,该电池放电时,正极的反应式为________________________________。
Ⅱ、一定质量的液态化合物XY2在标准状况下的一定质量的O2中恰好完全燃烧,反应方程式为: XY2(l)+3O2 (g) ="==" XO2(g)+2YO2 (g)冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56g/L则: (1)反应前O2的体积是________。(2)化合物XY2的摩尔质量是___________。
(3)XY2分子中X、Y两元素质量比是3∶16, X、Y两元素分别为__________ (写元素符号)。
、12分) (每空2分)
Ⅰ (1)5 (2)2NH3+NaClO=N2H4+NaCl+H2O
(3)O2+2H2O +4e-=4OH-
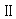 (1)672 mL (2)76 g/mol (3)C 、 S
(1)672 mL (2)76 g/mol (3)C 、 S
Ⅰ (1)5 (2)2NH3+NaClO=N2H4+NaCl+H2O
(3)O2+2H2O +4e-=4OH-
 (1)672 mL (2)76 g/mol (3)C 、 S
(1)672 mL (2)76 g/mol (3)C 、 S Ⅰ (1)根据原子核外电子的排布规律可知,氮元素原子的L层电子数为5个。
(2)根据原子守恒可知,还有氯化钠和水生成,所以反应的方程式是
2NH3+NaClO=N2H4+NaCl+H2O。
(3)原电池中分解失去电子,正极得到电子,所以正极是氧气得到电子。电解质溶液显碱性,所以正极电极反应式是O2+2H2O +4e-=4OH-。
Ⅱ、(1)根据反应的方程式可知,反应前后体积是不变的,所以反应前氧气的体积是672ml。
(2)氧气的物质的量是0.03mol,质量是0.96g。反应后气体的质量是0.672L×2.56g/L=1.72032,所以根据质量守恒定律可知,参加反应的XY2的质量是0.76032g。又因为XY2的物质的量是0.01mol,所以该化合物的摩尔质量是0.76032g÷0.01mol=76g/mol。
(3)根据化学式可知,X、Y两元素的摩尔质量之比是6︰16=12︰32,所以X是C,Y是S。
(2)根据原子守恒可知,还有氯化钠和水生成,所以反应的方程式是
2NH3+NaClO=N2H4+NaCl+H2O。
(3)原电池中分解失去电子,正极得到电子,所以正极是氧气得到电子。电解质溶液显碱性,所以正极电极反应式是O2+2H2O +4e-=4OH-。
Ⅱ、(1)根据反应的方程式可知,反应前后体积是不变的,所以反应前氧气的体积是672ml。
(2)氧气的物质的量是0.03mol,质量是0.96g。反应后气体的质量是0.672L×2.56g/L=1.72032,所以根据质量守恒定律可知,参加反应的XY2的质量是0.76032g。又因为XY2的物质的量是0.01mol,所以该化合物的摩尔质量是0.76032g÷0.01mol=76g/mol。
(3)根据化学式可知,X、Y两元素的摩尔质量之比是6︰16=12︰32,所以X是C,Y是S。

练习册系列答案
 互动课堂系列答案
互动课堂系列答案
相关题目
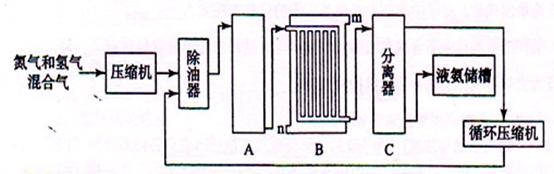
 CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于
CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 
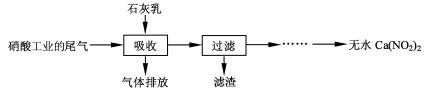
 N2O3(g),其平衡常数表达式为K=________。
N2O3(g),其平衡常数表达式为K=________。