题目内容
11.醋酸是一种常见的弱酸,回答下列问题:(1)醋酸的电离方程式是CH3COOH?CH3COO-+H+;下列哪些措施能够使醋酸溶液中$\frac{c({H}^{+})}{c(C{H}_{3}CO{O}^{-})}$ 增大的是bd
a.升温 b.通入HCl气体 c.加入NaOH固体 d.加入NaHSO4固体
(2)向100mL0.1mol•L-1的醋酸中加入V mL0.1mol•L-1的NaOH溶液完全反应后,溶液呈中性,则V<100mL(填“>”,“<”或“=”)
(3)在CH3COOH与CH3COONa的混合溶液中,测得某一时刻混合溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18,则此时溶液的pH=6(已知:CH3COOH的电离常数Ka=1.8×10-5)
(4)为测定食用醋中醋酸的含量(用每升食醋中所含醋酸的质量表示,单位:g/L),设计如下实验:a.取20ml食醋于锥形瓶中,滴加2-3滴酚酞作指示剂.b.向碱式滴定管中加入1mol•L-1的NaOH溶液,调整液面,并记下初始刻度.c.开始滴定,并记录滴定终点时碱式滴定管的刻度,重复试验2-3次.
①达到滴定终点时的现象是当最后一滴NaOH溶液滴下,锥形瓶中由无色变为粉红色,且半分钟颜色不褪去
②经过测定,消耗NaOH溶液的体积为10mL,则该食醋中醋酸的含量是30g/L.
分析 (1)醋酸是弱酸,电离可逆;使醋酸溶液中$\frac{c({H}^{+})}{c(C{H}_{3}CO{O}^{-})}$ 增大,可以增大氢离子浓度或减小醋酸根离子浓度;
(2)醋酸钠溶液显碱性;
(3)在CH3COOH与CH3COONa的混合溶液中,存在醋酸的电离平衡CH3COOH?CH3COO-+H+,据CH3COOH的电离常数Ka=1.8×10-5计算;
(4)酚酞在酸性溶液中显无色,用NaOH溶液滴定醋酸达到滴定终点时,溶液有无色变红色;醋酸与NaOH铵1:1的比例反应,据消耗NaOH的物质的量计算20mL食醋中含有醋酸的物质的量,再计算其含量.
解答 解:(1)醋酸是弱酸,电离可逆,其电离方程式为CH3COOH?CH3COO-+H+,升温醋酸的电离平衡正向移动,$\frac{c({H}^{+})}{c(C{H}_{3}CO{O}^{-})}$ 不变,加入NaOH固体,氢离子浓度减小,$\frac{c({H}^{+})}{c(C{H}_{3}CO{O}^{-})}$ 减小,通入HCl气体或加入NaHSO4固体能够增大氢离子浓度,使$\frac{c({H}^{+})}{c(C{H}_{3}CO{O}^{-})}$ 增大,故答案为:CH3COOH?CH3COO-+H+;bd;
(2)向100mL0.1mol•L-1的醋酸中加入100 mL0.1mol•L-1的NaOH溶液完全反应,恰好生成醋酸钠,醋酸钠溶液显碱性,若使溶液显中性,需加入NaOH溶液的体积小于100mL,故答案为:<;
(3)在CH3COOH与CH3COONa的混合溶液中,存在醋酸的电离平衡CH3COOH?CH3COO-+H+,据CH3COOH的电离常数Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=1.8×10-5,又$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18,则c(H+)=$\frac{1.8×1{0}^{-5}}{18}$=1.0×10-6,所以pH=6,故答案为:6;
(4)①滴定终点时,溶液颜色有无色变为红色,且且半分钟颜色不褪去,故答案为:当最后一滴NaOH溶液滴下,锥形瓶中由无色变为粉红色,且半分钟颜色不褪去;
②醋酸与NaOH铵1:1的比例反应,20mL食醋中含有醋酸的物质的量为1mol•L-1×0.01L=0.01mol,所以该食醋中醋酸的含量为$\frac{0.01mol×60g/mol}{0.02L}$=30g/L,故答案为:30 g/L.
点评 本题考查了醋酸的电离方程式书写、影响醋酸电离平衡移动的因素、盐类水解、有关电离平衡常数的计算、酸碱中和滴定,题目难度不大.

实验药品:2.0mol•L-1盐酸、4.0mol•L-1盐酸、2.0mol•L-1硫酸、4.0mol•L-1硫酸,相同大小的铝片和铝粉(表面氧化膜都已除去).每次实验各种酸的用量均为50.0ml,金属用量均为9.0g.
(1)帮助该同学完成以下实验设计表.
| 实验目的 | 实验编号 | 温度 | 金属铝形态 | 酸及其浓度 |
| 1.实验Ⅰ和Ⅱ探究盐酸浓度对该反应速率的影响 2.实验Ⅱ和Ⅲ探究:③ 3.实验Ⅱ和Ⅳ探究金属规格(铝片、铝粉)对该反应速率的影响 4.Ⅰ、Ⅱ、Ⅲ实验探究铝与稀盐酸和稀硫酸反应的差异 | Ⅰ | 25℃ | 铝片 | 4.0moL/L盐酸 |
| Ⅱ | 25℃ | 铝片 | 2.0mol•L-1盐酸 | |
| Ⅲ | 35℃ | 铝片 | 2.0mol•L-1盐酸 | |
| Ⅳ | 25℃ | 铝片 | 2.0moL/L盐酸 | |
| Ⅴ | 25℃ | 铝片 | 2.0mol•L-1硫酸 |
| A. | 将纯铁片放入稀硫酸中,反应缓慢,再加入少量硫酸溶液,可加快产生氢气的速率 | |
| B. | 用锌片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率 | |
| C. | 反应2H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 | |
| D. | 稀盐酸跟锌片反应,加入少量的氯化钠固体,反应速率不变 |
| A. | 四氯化碳的电子式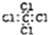 | B. | C2H4的球棍模型 | ||
| C. | 环已烷的结构简式 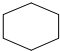 | D. | 次氯酸的结构式:H-Cl-O |
| A. | 负极的反应式为CH3OH+H2O-6e-═CO2↑+6H+ | |
| B. | 氧气在电极上的反应是O2+4H++4e-═2H2O | |
| C. | 电池工作时,H+由正极移向负极 | |
| D. | 电池工作时,电子从通入甲醇的一极流出,经外电路流入通入氧气的一极 |
| A. | ${\;}_{53}^{127}$I和${\;}_{53}^{131}$I的核外电子数不同 | |
| B. | ${\;}_{53}^{127}$I和${\;}_{53}^{131}$I的中子数分别为74和78 | |
| C. | ${\;}_{53}^{127}$I和${\;}_{53}^{131}$I属不同种元素 | |
| D. | ${\;}_{53}^{127}$I和${\;}_{53}^{131}$I是同一种核素 |

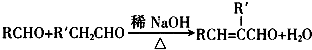 (R、R′表示烃基或氢)
(R、R′表示烃基或氢)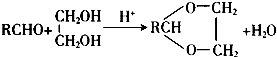
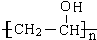 .
.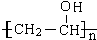 →
→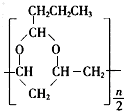 +$\frac{n}{2}$H2O.
+$\frac{n}{2}$H2O.