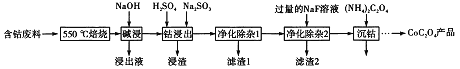
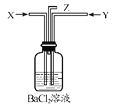
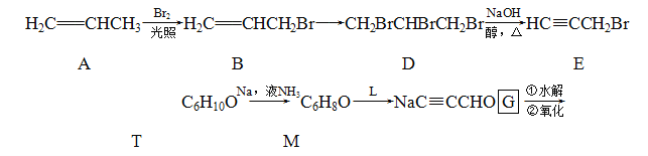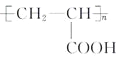题目内容
【题目】常温下,将等浓度的FeSO4和(NH4)2SO4两种浓溶液混合可制得一种晶体,该晶体(称摩尔盐)是分析化学中常用的一种还原剂,其强热分解反应化学方程式:2(NH4)2Fe(SO4)2·6H2O![]() Fe2O3+2NH3↑+N2↑+4SO2↑+17H2O。下列说法正确的是( )
Fe2O3+2NH3↑+N2↑+4SO2↑+17H2O。下列说法正确的是( )
A. 该反应中氧化产物是N2、NH3,还原产物是SO2、Fe2O3
B. 1mol摩尔盐强热分解时转移电子的物质的量为8NA
C. 向摩尔盐溶液中滴入足量浓NaOH溶液,最终可得刺激性气体和红褐色沉淀
D. 常温下,摩尔盐的溶解度比FeSO4、(NH4)2SO4大
【答案】C
【解析】
反应中铁元素化合价升高,氮元素化合价升高,硫元素化合价降低。据此分析。
反应中铁元素化合价升高,氮元素化合价升高,硫元素化合价降低。A. 该反应中氧化产物是N2、Fe2O3,还原产物是SO2,故错误;
B. 反应中转移8个电子,所以1mol摩尔盐强热分解时转移电子的物质的量为4NA,故错误;
C. 向摩尔盐溶液中滴入足量浓NaOH溶液,可得刺激性气体氨气和氢氧化亚铁白色沉淀,但氢氧化亚铁沉淀能被空气中的氧气氧化,最终氢氧化铁红褐色沉淀,故正确;
D. 将等浓度的FeSO4和(NH4)2SO4两种浓溶液混合可制得一种晶体,说明常温下,摩尔盐的溶解度比FeSO4、(NH4)2SO4小,故错误。
故选C。

练习册系列答案
相关题目