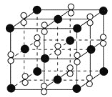
题目内容
【题目】二硫化钨(WS2,WS2中W的化合价为+4)可用作润滑剂及石油化工领域中的催化剂。由钨铁矿(其主要成分是FeWO4,还含少量Al2O3)制备二硫化钨的工艺流程如下:
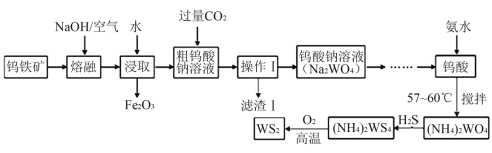
请回答下列问题:
(1)“滤渣Ⅰ”的化学式为__________;
(2)提高“熔融”速率的措施有_____________________(写一条即可);
(3)用离子方程式表示通入过量CO2的主要目的是:________________________;
(4)钨酸与氨水反应时控制温度为58℃,温度不宜太高,其原因是___________。
(5)已知2(NH4)2WS4+3O2![]() 2WS2+4NH3+2S+2SO2+2H2O,若该反应转移了8 mol电子,则生成的气体产物在标准状况下的体积为______L;
2WS2+4NH3+2S+2SO2+2H2O,若该反应转移了8 mol电子,则生成的气体产物在标准状况下的体积为______L;
(6)常温下,Ksp(CaWO4) =1×10-10。在钨酸钠溶液中滴加澄清石灰水产生钨酸钙沉淀,当溶液中pCa=-1g c(Ca2+)=4,c(WO42-)=_____mol/L。
【答案】Al(OH)3 增大氧气的通入量、搅拌、增大NaOH溶液的浓度等任意一种 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 一水合氨不稳定,受热分解 67.2 1×10-6
【解析】
由流程可知,钨酸亚铁和氢氧化钠、氧气反应生成氧化铁和钨酸钠,Al2O3和NaOH反应生成NaAlO2,水浸时,可除去不溶于水的氧化铁,向粗钨酸钠溶液中通入过量CO2,经过滤后得到的滤液含钨酸钠,滤渣I的主要成份是Al(OH)3,滤液再经酸化得钨酸,向钨酸中加入氨水并控制温度得钨酸铵,继续通入H2S气体,生成(NH4)2WS4,最后将(NH4)2WS4在氧气中高温加热即可得到WS2。
(1)粗钨酸钠溶液中含有NaAlO2,向其中通入过量CO2,NaAlO2与CO2、H2O反应产生Al(OH)3沉淀,所以“滤渣Ⅰ”为Al(OH)3;
(2)熔融的钨铁矿与NaOH溶液、氧气会发生反应:FeWO4+8NaOH+O2![]() 2Fe2O3+Na2WO4+4H2O,能够提高该反应速率的因素有增大氧气的通入量、搅拌、增大NaOH溶液的浓度等;
2Fe2O3+Na2WO4+4H2O,能够提高该反应速率的因素有增大氧气的通入量、搅拌、增大NaOH溶液的浓度等;
(3)在含有NaAlO2的溶液中通入过量CO2气体,生成Al(OH)3沉淀和NaHCO3溶液,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)钨酸与氨水反应时控制温度为58℃,温度太高,氨水中的一水合氨分解产生的氨气逸出,导致反应物浓度降低,不利于反应的进行;
(5)在反应2(NH4)2WS4+3O2![]() 2WS2+4NH3+2S+2SO2+2H2O中,(NH4)2WS4中+6价W被还原为+4价的WS2,-2价S元素被氧化成0价的S单质,-2价S元素被氧化成+4价的SO2,O2得到电子被还原为-2价的O,每反应生成2 mol WS2,同时得到4 mol NH3、2 mol SO2气体,共6 mol气体,反应中共转移16 mol电子,若该反应转移了8 mol电子,则反应产生气体的物质的量是3 mol,反应产生气体在标准状况下的体积V=3 mol×22.4 L/mol=67.2 L;
2WS2+4NH3+2S+2SO2+2H2O中,(NH4)2WS4中+6价W被还原为+4价的WS2,-2价S元素被氧化成0价的S单质,-2价S元素被氧化成+4价的SO2,O2得到电子被还原为-2价的O,每反应生成2 mol WS2,同时得到4 mol NH3、2 mol SO2气体,共6 mol气体,反应中共转移16 mol电子,若该反应转移了8 mol电子,则反应产生气体的物质的量是3 mol,反应产生气体在标准状况下的体积V=3 mol×22.4 L/mol=67.2 L;
(6)常温下,Ksp(CaWO4) =1×10-10。在钨酸钠溶液中滴加澄清石灰水产生钨酸钙沉淀,当溶液中pCa=-1g c(Ca2+)=4,c(Ca2+)=1×10-4 mol/L,c(WO42-)=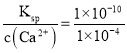 mol/L=1×10-6 mol/L。
mol/L=1×10-6 mol/L。