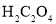题目内容
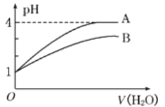
【题目】25℃时,某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数δ随溶液pH的变化曲线如图所示:下列说法正确的是( )

A.pH=7.2时,溶液中c(H2PO4ˉ)+c(HPO42-)+c(OHˉ)=c(Na+)+c(H+)
B.曲线1和曲线2分别表示δ(H3PO4)和δ(HPO42-)的变化
C.pH=12.3时,溶液中由水电离出的c(H+)=10-12.3mol/L
D.25℃时,H3PO4的电离常数K1=10-2.1
【答案】D
【解析】
A. pH=7.2时,溶液中c(H2PO4ˉ)+2c(HPO42-)+3c(PO43-)+c(OHˉ)=c(Na+)+c(H+),A错误;
B. 曲线1和曲线2分别表示δ(H3PO4)和δ(H2PO4-)的变化,B错误;
C. pH=12.3时,溶液中的溶质是Na3PO4和Na2HPO4,溶液中的OH-全部来自水电离,溶液中的H+来自水和HPO42-的电离,只是水电离的H+大部分与PO43-、HPO42-结合,所以由水电离出的c(H+)水= c(OHˉ)溶液=10-1.7mol/L,C错误;
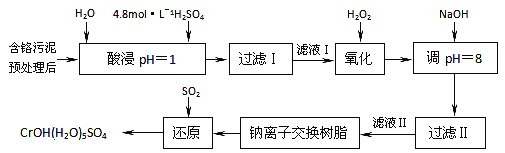
D. 25℃时,在pH=2.1点,c(H2PO4ˉ)=c(H3PO4),H3PO4的电离常数K1=![]() =10-2.1,D正确。
=10-2.1,D正确。
故选D。

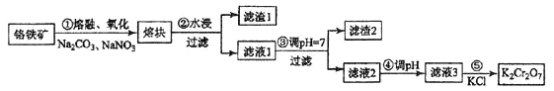
【题目】某工厂对制革工业污泥中铬的处理工艺流程如下:
已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有_________、___________。(答出两点)。
(2)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 5.4(>8溶解) | 9(>9溶解) |
①用NaOH调节溶液的pH不能超过8,其理由是________________________________。
②常温下,当pH=8时,Mg2+是否开始沉淀(溶液中镁离子浓度不超过1mol·L-1)___________ 。 (填“是”或“否”)若要使Mg2+完全沉淀,溶液的pH至少为_________(已知Ksp[Mg(OH)2]=1. 6×10-12,lg2=0.3)。