题目内容
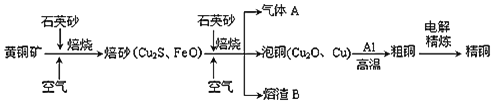
【题目】菱铁矿![]() 主要成分是
主要成分是![]() 是炼铁的原料.已知
是炼铁的原料.已知![]() 为白色固体,不溶于水,在干燥空气中稳定,潮湿环境中需较长时间被氧化为
为白色固体,不溶于水,在干燥空气中稳定,潮湿环境中需较长时间被氧化为![]() .
.
I.![]() 甲同学取一定量碳酸亚铁固体于烧杯中,加入足量水,将烧杯放置在天平左盘上,向右盘放入砝码至天平平衡.放置较长时间后
甲同学取一定量碳酸亚铁固体于烧杯中,加入足量水,将烧杯放置在天平左盘上,向右盘放入砝码至天平平衡.放置较长时间后![]() 不考虑水分蒸发
不考虑水分蒸发![]() ,观察到天平的指针会______
,观察到天平的指针会______![]() 填“偏左”、“偏右”、“不发生偏转”
填“偏左”、“偏右”、“不发生偏转”![]() ;放置过程中还可观察到的实验现象为______.
;放置过程中还可观察到的实验现象为______.
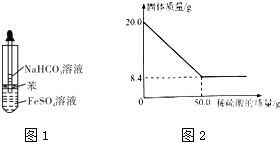
![]() 乙同学设计图1所示的装置制备
乙同学设计图1所示的装置制备![]() 和
和![]() 溶液均用经煮沸后冷却的蒸馏水配制,并在
溶液均用经煮沸后冷却的蒸馏水配制,并在![]() 溶液中加入少量铁粉
溶液中加入少量铁粉![]() 滴加
滴加![]() 溶液后观察到试管中出现白色沉淀,同时有大量无色气体生成.
溶液后观察到试管中出现白色沉淀,同时有大量无色气体生成.
![]() 产生的气体是______
产生的气体是______![]() 填分子式
填分子式![]() .
.
![]() 丙同学对白色沉淀的成分提出异议,并做出如下假设,请补充完成假设3:
丙同学对白色沉淀的成分提出异议,并做出如下假设,请补充完成假设3:
假设1:白色沉淀是![]() ;
;
假设2:白色沉淀是![]() ;
;
假设3:白色沉淀是______.
![]() 若假设1成立,写出有关反应的化学方程式:______.
若假设1成立,写出有关反应的化学方程式:______.
![]() 若假设2成立,说明用经煮沸后冷却的蒸馏水配制
若假设2成立,说明用经煮沸后冷却的蒸馏水配制![]() 和
和![]() 溶液的目的是______.请设计一个实验方案验证假设2成立,写出实验步骤、预期现象和结论,实验所需仪器和药品自选. ______.
溶液的目的是______.请设计一个实验方案验证假设2成立,写出实验步骤、预期现象和结论,实验所需仪器和药品自选. ______.
![]() 现取
现取![]() 菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如图2所示.
菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如图2所示.![]() 假设菱铁矿中杂质不参加反应,且难溶于水.
假设菱铁矿中杂质不参加反应,且难溶于水.![]()
![]() 菱铁矿中
菱铁矿中![]() 的质量分数为______
的质量分数为______
![]() 若将稀硫酸改成1mol
若将稀硫酸改成1mol![]() ,则该反应的离子方程式为______
,则该反应的离子方程式为______![]() 将反应逸出的气体与一定量的
将反应逸出的气体与一定量的![]() 混合循环通入反应液中,目的是______.
混合循环通入反应液中,目的是______.
![]() 某铁锈成分为
某铁锈成分为![]() 和
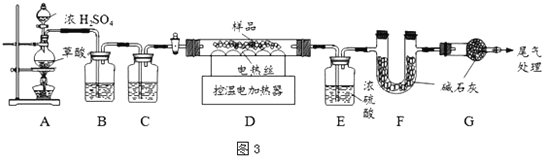
和![]() 为确定其组成,兴趣小组称取此铁锈样品
为确定其组成,兴趣小组称取此铁锈样品![]() ,在科研人员的指导下用图3装置进行实验.
,在科研人员的指导下用图3装置进行实验.
(查阅资料)
①![]() 失去结晶水温度为
失去结晶水温度为![]() ,
,![]() 在
在![]() 分解为FeO和
分解为FeO和![]() .
.
②温度高于![]() 时铁的氧化物才能被CO还原.
时铁的氧化物才能被CO还原.
![]() 装配好实验装置后,首先要______.
装配好实验装置后,首先要______.
![]() 装置A中的反应为:
装置A中的反应为: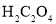
![]() 草酸)
草酸) 
![]() 通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放______
通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放______![]() 选填序号
选填序号![]() .
.
![]() 浓硫酸
浓硫酸![]() 澄清的石灰水
澄清的石灰水![]() 氢氧化钠溶液
氢氧化钠溶液
![]() 现控制D装置中的温度为
现控制D装置中的温度为![]() 对铁锈进行热分解,直至D装置中剩余固体质量不再变化为止,冷却后装置E增重
对铁锈进行热分解,直至D装置中剩余固体质量不再变化为止,冷却后装置E增重![]() ,装置F增重
,装置F增重![]() .则样品中
.则样品中![]() 的质量
的质量![]() ______g,
______g,![]() ______.
______.
![]() 若缺少G装置,测得的
若缺少G装置,测得的![]() ______
______![]() 选填“偏大”、“偏小”、“不变”,下同
选填“偏大”、“偏小”、“不变”,下同![]() ,x的值会______.
,x的值会______.
【答案】偏右 白色固体变成红褐色固体![]() 或产生气泡
或产生气泡![]()
![]()
![]() 和
和![]()
![]() 除去水中溶解的氧气,防止生成的
除去水中溶解的氧气,防止生成的![]() 被迅速氧化 向产生白色沉淀的试管中通入空气,若白色沉淀迅速变成灰绿色,最后变为红褐色,则说明假设2成立
被迅速氧化 向产生白色沉淀的试管中通入空气,若白色沉淀迅速变成灰绿色,最后变为红褐色,则说明假设2成立 ![]()
![]() 减少环境污染,NO跟
减少环境污染,NO跟![]() 、
、![]() 反应后又得到硝酸,提高原料利用率 检查装置气密性
反应后又得到硝酸,提高原料利用率 检查装置气密性 ![]()
![]() 2 偏大 偏大
2 偏大 偏大
【解析】
(1)在有水与空气下,放置较长时间后,碳酸亚铁会发生反应:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2,根据方程式左边质量如何变化; FeCO3是白色固体、Fe(OH)3红褐色固体;
(2)HCO3-和Fe 2+相互促进水解生成Fe(OH)2和CO2;
(3)根据组合可推知假设3为Fe(OH)2和FeCO3的混合物;
(4)如果白色沉淀的碳酸亚铁,则硫酸亚铁和碳酸氢钠发生复分解反应,为非氧化还原反应,根据元素守恒及产物的稳定性推知反应方程式;
(5)如果生成氢氧化亚铁,说明煮沸后溶液中不含氧气;产物Fe(OH)2验证可通过学生熟悉的颜色变化来设计,向溶液中通入氧气,根据物质颜色是否变化判断;
(6)碳酸亚铁和稀硫酸反应生成硫酸亚铁和二氧化碳、水,剩余固体为未反应的杂质,则参加反应的m(FeCO3)=(20.0-8.4)g=11.6g,碳酸亚铁的质量分数= ![]() ×100%;
×100%;
(7) 碳酸亚铁与硝酸发生氧化还原反应,铁的产物为+3价,稀硝酸还原产生为NO,NO与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸;
(8)实验基本操作,装配好实验装置后,首先要检查装置气密性;
(9)二氧化碳是酸性氧化物,要除去CO2应该选取溶解性大的碱性溶液;
(10)温度为300℃时,Fe2O3xH2O失去结晶水(分解温度为110℃),FeCO3分解为FeO和CO2(分解温度为282℃),装置E增重3.6g为水,n(H2O)=0.2mol,根据水分子守恒得n(Fe2O3xH2O)=![]() mol,装置F增重2.2g为二氧化碳,n(CO2)=0.05mol,根据C原子守恒得n(FeCO3)=0.05mol,0.05molFeCO3质量为:0.05mol×116molL-1=5.8g;则Fe2O3xH2O质量为:25.4g-5.8g=19.6g,
mol,装置F增重2.2g为二氧化碳,n(CO2)=0.05mol,根据C原子守恒得n(FeCO3)=0.05mol,0.05molFeCO3质量为:0.05mol×116molL-1=5.8g;则Fe2O3xH2O质量为:25.4g-5.8g=19.6g,![]() mol×(160+18x)molL-1=19.6g,据此计算x值;
mol×(160+18x)molL-1=19.6g,据此计算x值;
(11)若缺少G装置,F会吸收部分空气中的水与二氧化碳而增重。
(1)在有水与空气下,放置较长时间后,碳酸亚铁会发生反应:![]() ,从而使左边物质质量变大,则指针或偏右;碳酸亚铁是白色固体、氢氧化铁是红褐色固体,所以颜色也由
,从而使左边物质质量变大,则指针或偏右;碳酸亚铁是白色固体、氢氧化铁是红褐色固体,所以颜色也由![]() 白色变为
白色变为![]() 红褐色;
红褐色;
(2)![]() 和
和![]() 相互促进水解生成
相互促进水解生成![]() 和
和![]() ,溶液中产生的气体为
,溶液中产生的气体为![]() ;
;
(3)根据组合可推知假设3为![]() 和
和![]() ;
;
(4)如果白色沉淀的碳酸亚铁,则硫酸亚铁和碳酸氢钠发生复分解反应,为非氧化还原反应,根据元素守恒及产物的稳定性推知反应方程式为:![]() ;
;
(5)煮沸后冷却的蒸馏水配制![]() 和
和![]() 溶液可以除去水中溶解的氧气,防止生成的
溶液可以除去水中溶解的氧气,防止生成的![]() 被迅速氧化;而产物
被迅速氧化;而产物![]() 验证可通过学生熟悉的颜色变化来设计,其检验方法为向产生白色沉淀的试管中通入空气,若白色沉淀迅速变成灰绿色,最后变为红褐色,则说明假设2成立;
验证可通过学生熟悉的颜色变化来设计,其检验方法为向产生白色沉淀的试管中通入空气,若白色沉淀迅速变成灰绿色,最后变为红褐色,则说明假设2成立;
(6)碳酸亚铁和稀硫酸反应生成硫酸亚铁和二氧化碳、水,剩余固体为未反应的杂质,则参加反应的![]() ,碳酸亚铁的质量分数
,碳酸亚铁的质量分数![]() ;
;
(7)碳酸亚铁与硝酸发生氧化还原反应,铁的产物为![]() 价,稀硝酸还原产生为NO,反应方程式为
价,稀硝酸还原产生为NO,反应方程式为![]() ,NO与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,为防止NO污染空气,且为提高原料利用率,需循环使用NO;
,NO与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,为防止NO污染空气,且为提高原料利用率,需循环使用NO;
(8)实验基本操作,装配好实验装置后,首先要检查装置气密性;
(9)二氧化碳是酸性氧化物,要除去![]() 应该选取溶解性大的碱性溶液,要除去
应该选取溶解性大的碱性溶液,要除去![]() 最好选择氢氧化钠溶液,澄清的石灰水浓度低,碱性弱;
最好选择氢氧化钠溶液,澄清的石灰水浓度低,碱性弱;
(10)温度为![]() 时,
时,![]() 失去结晶水
失去结晶水![]() 分解温度为
分解温度为![]() ,
,![]() 分解为FeO和
分解为FeO和![]() 分解温度为
分解温度为![]() ,装置E增重
,装置E增重![]() 为水,
为水,![]() ,根据水分子守恒得
,根据水分子守恒得![]() ,装置F增重
,装置F增重![]() 为二氧化碳,
为二氧化碳,![]() ,根据C原子守恒得
,根据C原子守恒得![]() ,
,![]()
![]() 质量为:
质量为:![]() ,则
,则![]() 质量为:
质量为:![]() ,
,![]()
![]() ,解得
,解得![]() ;
;
(11)若缺少G装置,F会吸收部分空气中的水与二氧化碳而增重,使测得的![]() 偏大,计算所得
偏大,计算所得![]() 质量偏小,而计算出的x偏大。
质量偏小,而计算出的x偏大。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |

A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B. 丙容器的体积V>0.5L
C. 当温度为T1℃时,反应的平衡常数K=2.25
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2
【题目】已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:_______________________________。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:_____________。
(3)“调pH”时pH的调控范围为__________________。
(4)写出“沉镍”时发生反应的离子方程式:________________________________,证明Ni2+已经沉淀完全的实验步骤及现象是______________________________,当Ca2+沉淀完全时,溶液中c(F-)>____________mol·L-1(写出计算式即可)。