题目内容
【题目】H、N、Na、Al、Ti等元素在能源、材料等领域应用广泛。回答下列问题:
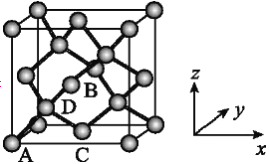
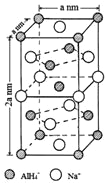
(一)氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如图所示,为长方体。
(1)基态Ti原子的价电子排布图为_________,L能层中电子云的形状有_______种。
(2)AlCl3在178℃时升华,属于__________晶体,其蒸气的相对分子质量约为267,蒸气分子的结构式为___________(标明配位键),其中Al的轨道杂化方式为____________。
(3)写出与AlH4-空间构型相同的一种分子和一种离子_________(填化学式)。
(4)NaAlH4晶体中,与AlH4-紧邻且等距的Na+有__________个;NaAlH4晶体的密度为_____________g·cm-3(用含a的代数式表示)。
(二)叠氮化钠和氢叠氮酸(HN3)已一步步进入我们的生活,如汽车安全气囊等。
(1)写出与N3-属于等电子体的一种分子__________(填分子式)。
(2)氢叠氮酸(HN3)可由肼(N2H4)被HNO2氧化制得,同时生成水。下列叙述错误的是___(填标号)
A.上述生成HN3的化学方程式为:N2H4+HNO2= HN3+2 H2O
B.NaN3的晶格能大于KN3的晶格能
C.氢叠氮酸(HN3)和水能形成分子间氢键
D.HN3和N2H4都是由极性键和非极性键构成的非极性分子。
E.HN3分子中四个原子可能在一条直线上
【答案】 (1)![]() 2 分子
2 分子 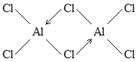 sp3 NH4+、CH4(或SO42-、PO43-、CCl4等其他合理答案) 8
sp3 NH4+、CH4(或SO42-、PO43-、CCl4等其他合理答案) 8 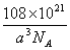 CO2或N2O DE
CO2或N2O DE
【解析】分析:钛是22号元素。L层只有s和p两种原子轨道。根据氯化铝易升华,可以判断其为分子晶体。根据中心原子所形成的σ键数目及孤电子对数可以确定其杂化类型。AlH4-空间构型为正四面体。根据均摊法可以计算出晶胞中的微粒数,再以1mol晶胞为单位,计算其体积和质量,即可求出其密度。等电子体之间原子数目相同、价电子总数相同。
详解:(一)(1)钛是22号元素,基态Ti原子的价电子排布图为![]() 。L能层中有s和p丙种轨道,故电子云的形状有2种。
。L能层中有s和p丙种轨道,故电子云的形状有2种。
(2)AlCl3在178℃时升华,说明其熔点和沸点较低,故其属于分子晶体,其蒸气的相对分子质量约为267,则蒸气分子的分子式为Al2Cl6,分子中有2个配位键,其结构式为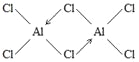 ,其中Al形成4个σ键、无孤电子对,故其轨道杂化方式为sp3。
,其中Al形成4个σ键、无孤电子对,故其轨道杂化方式为sp3。
(3)AlH4-空间构型为正四面体,与AlH4-空间构型相同的分子和离子主要有CCl4、CH4、SO42-、PO43-、NH4+等。
(4)由NaAlH4晶体的晶胞结构可知,,与AlH4-紧邻且等距的Na+有8个(如图所示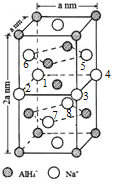 ,位于体心的AlH4-与其周围的8个Na+等距,距离为
,位于体心的AlH4-与其周围的8个Na+等距,距离为![]() );由均摊法可以求出该晶胞中阴阳离子的数目均为4,则NA个晶胞的质量和体积分别为216g和2
);由均摊法可以求出该晶胞中阴阳离子的数目均为4,则NA个晶胞的质量和体积分别为216g和2![]() ,所以,NaAlH4晶体的密度为
,所以,NaAlH4晶体的密度为![]() g·cm-3。
g·cm-3。
(二)(1)N3-有3个原子和16个价电子,故与N3-属于等电子体的分子有CO2或N2O。
(2)氢叠氮酸(HN3)可由肼(N2H4)被HNO2氧化制得,同时生成水。A.上述生成HN3的化学方程式为N2H4+HNO2= HN3+2 H2O ,A正确;B.钠离子的半径小于钾离子,故NaN3的晶格能大于KN3的晶格能,B正确;C.氢叠氮酸(HN3)和水能形成分子间氢键,C正确;D.HN3是极性分子,N2H4是非极性分子,D不正确;E.HN3分子结构示意图为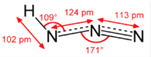 ,靠近H原子的第1个N原子是sp2杂化的,第二个N原子是sp杂化的,端位的N原子不杂化,故四个原子不在一条直线上,E不正确。综上所述,叙述错误的是DE 。
,靠近H原子的第1个N原子是sp2杂化的,第二个N原子是sp杂化的,端位的N原子不杂化,故四个原子不在一条直线上,E不正确。综上所述,叙述错误的是DE 。

【题目】CO2的利用是国际社会普遍关注的问题。
(1)CO2的电子式是______。
(2)CO2在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
![]()
获取乙二醇的反应历程可分为如下2步:
Ⅰ.
Ⅱ.EC加氢生成乙二醇与甲醇
![]()
① 步骤Ⅱ的热化学方程式是______。
② 研究反应温度对EC加氢的影响(反应时间均为4小时),实验数据见下表:
反应温度/ ℃ | EC转化率/ % | 产率/ % | |
乙二醇 | 甲醇 | ||
160 | 23.8 | 23.2 | 12.9 |
180 | 62.1 | 60.9 | 31.5 |
200 | 99.9 | 94.7 | 62.3 |
220 | 99.9 | 92.4 | 46.1 |
由上表可知,温度越高,EC的转化率越高,原因是______。温度升高到220 ℃时,乙二醇的产率反而降低,原因是______。
(3)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如下图所示,电极a接电源的______极(填“正”或“负”),生成甲醇的电极反应式是______。

(4)CO2较稳定、能量低。为实现CO2的化学利用,下列研究方向合理的是______(填序号)。
a.选择高能量的反应物和CO2反应获得低能量的生成物
b.利用电能、光能或热能活化CO2分子
c.选择高效的催化剂