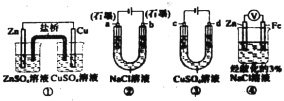
题目内容
【题目】根据金属及其化合物的所学知识回答下列问题:
(1)常温下,在没有氧气存在时,铁与水几乎不反应,但在高温时,铁能与水蒸气反应,写出化学反应方程式:_______________________________。
(2)待(1)中反应完全,反应产物中Fe元素化合价为_________,该产物与盐酸反应的离子方程式为:__________________________________。
(3)将铁粉投入到盛有Cu2+和Fe3+的溶液中,反应完毕时,若烧杯底部有固体剩余,在所涉及的金属元素内溶液中一定不含有的金属离子是________(填离子符号),写出证明溶液中不含有该离子的实验操作:______________________。
(4)某同学将铁、铜混合粉末14.8 g加入到100 mL 4.0 mol/L FeCl3溶液中,充分反应后,烧杯底部还有剩余固体,其质量为2.8 g,则原固体混合物中铜的质量是______g,反应所得溶液中的Fe2+物质的量为_____mol。
【答案】3Fe+H2O(g)![]() Fe3O4+4H2 +2、+3 Fe3O4+8H+=Fe2++2Fe3++4H2O Fe3+ 取少量反应后的溶液于试管,向其中滴加几滴KSCN溶液,若溶液不变红,证明溶液中不含Fe3+ 9.2 0.5
Fe3O4+4H2 +2、+3 Fe3O4+8H+=Fe2++2Fe3++4H2O Fe3+ 取少量反应后的溶液于试管,向其中滴加几滴KSCN溶液,若溶液不变红,证明溶液中不含Fe3+ 9.2 0.5
【解析】
(1)铁与水蒸气反应生成四氧化三铁和氢气,据此解答;
(2)根据四氧化三铁可以用FeO·Fe2O3表示分析解答;
(3)剩余的固体只能是铜或铜与铁的混合物,据此解答;
(4)由于铁比铜活泼,则与FeCl3溶液反应时的先后顺序为:Fe+2Fe3+=3Fe2+、Cu+2Fe3+=Cu2++2Fe2+,原氯化铁溶液中含有氯化铁的物质的量为:n(FeCl3)=4mol/L×0.1L=0.4mol,结合反应的方程式解答。
(1)常温下,在没有氧气存在时,铁与水几乎不反应,但在高温时,铁能与水蒸气反应生成四氧化三铁和氢气,反应的化学反应方程式为3Fe+H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)由于四氧化三铁可以用FeO·Fe2O3表示,所以四氧化三铁中Fe元素化合价为+2、+3价,与盐酸反应的离子方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O;
(3)将铁粉投入到盛有Cu2+和Fe3+的溶液中,铁离子首先氧化单质铁,如果铁过量,则继续和铜离子发生置换反应生成铜,因此反应完毕时,若烧杯底部有固体剩余,则溶液中一定不含有的金属离子是Fe3+,可以用KSCN溶液检验铁离子,即实验操作为取少量反应后的溶液于试管,向其中滴加几滴KSCN溶液,若溶液不变红,证明溶液中不含Fe3+;
(4)铁的还原性强于铜,把铁、铜混合粉末加入氯化铁溶液中,铁先与铁离子反应,氯化铁的物质的量是0.4mol,设0.4mol铁离子完全反应消耗铁、铜的质量分别为x、y,则:
Cu+2Fe3+=Cu2++2Fe2+
64g 2mol
y 0.4mol
解得y=12.8g
Fe+2Fe3+=3Fe2+
56g 2mol
x 0.4mol
解得x=11.2g
溶解的金属质量为:14.8g-2.8g=12g,11.2g<12g<12.8g,则铁完全反应、铜部分反应,因此剩余的金属为Cu,设反应消耗铜的物质的量为amol,反应的铁的物质的量为bmol,则64a+56b=12g、2a+2b=0.4mol,解得a=b=0.1,则原来混合物中含有的铜的质量为:0.1mol×64g/mol+2.8g=9.2g;根据反应方程式可知,反应后溶液中n(Fe2+)=2n(Cu)+3n(Fe)=2×0.1mol+3×0.10mol=0.5mol。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案【题目】现有一瓶甲和乙的混合物,已知甲和乙的某些性质如下表所示:
物质 | 熔点/℃ | 沸点/℃ | 密度/(g·cm-3) | 水中的溶解性 |
甲 | -98 | 57.5 | 0.93 | 可溶 |
乙 | -84 | 97 | 0.90 | 可溶 |
据此,将甲和乙相互分离的方法是( )
A.蒸馏法B.升华法C.萃取法D.过滤法
【题目】(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为 0.20mol·L-1的 MgCl2 和 CaCl2 混合溶液中逐滴加入 Na3PO4,先生成沉淀________(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度c________。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

已知: Ksp(BaC2O4)=1.6×10-7, Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
①毒重石用盐酸浸取前需充分研磨,目的是________。
②加入NH3·H2O调节pH=8 可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________________。