题目内容
【题目】锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件、医药及化工等领域。以辉锑矿为原料制备金属锑,其一种工艺流程如下:

己知部分信息如下:
I.辉锑矿(主要成分为Sb2S3,还含有As2S5、PbS 、CuO和SiO2等);
II.浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AsCl3和PbCl2等杂质;
III.常温下,Ksp(CuS)=1.0×10-36 Ksp(PbS)=9.0×10-29
回答下列问题:
(1)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是________(填化学式)。
(2)写出“还原”反应的化学方程式:______________ 。
(3)已知:浸出液中:c(Cu2+)=0.01 mol·L-1、c(Pb2+)=0.10 mol·L-1。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是_______(填化学式);当CuS、PbS共沉时,![]() =_________。加入硫化钠的量不宜过多,原因是_________。
=_________。加入硫化钠的量不宜过多,原因是_________。
(4)在“除砷”过程中,氧化产物为H3PO4。该反应中氧化剂、还原剂的物质的量之比___________。
(5)在“电解”过程中,以惰性材料为电极,阴极的电极反应式为______;“电解”中锑的产率与电压大小关系如图所示。当电压超过U0V时,锑的产率降低的原因可能是______。

【答案】 SbCl3 3 SbCl5+ 2Sb=5SbCl3 CuS 9.0×107 避免砷、锑离子沉淀 4:3 Sb3++3e-=Sb H+参与了电极反应
【解析】分析:由工艺流程可知,辉锑矿粉经盐酸、五氯化锑溶液浸取后,过滤,向滤液中加入适量的锑粉把过量的五氯化锑还原,然后再加入适量的硫化钠把溶液中的铜离子和铅离子沉淀,过滤,再向滤液中加入次磷酸钠除砷,得到三氯化锑溶液,电解该溶液得到锑和五氯化锑,五氯化锑循环利用。
详解:(1)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的氧化剂为SbCl5,其还原产物是SbCl3。
(2) “还原”反应的化学方程式为3SbCl5+ 2Sb=5SbCl3。
(3)浸出液中c(Cu2+)=0.01 mol·L-1、c(Pb2+)=0.10 mol·L-1。常温下,Ksp(CuS)=1.0×10-36 Ksp(PbS)=9.0×10-29,CuS的溶度积较小,故在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是CuS;当CuS、PbS共沉时,![]() =
= ![]() 9.0×107。加入硫化钠的量不宜过多,防止砷、锑离子转化为沉淀。
9.0×107。加入硫化钠的量不宜过多,防止砷、锑离子转化为沉淀。
(4)在“除砷”过程中,次磷酸钠是还原剂,其氧化产物为H3PO4,P的化合价由+1升高到+5、升高了4,而As的化合价由+3降到0、降低了3,故该反应中氧化剂、还原剂的物质的量之比4:3。
(5)在“电解”过程中,以惰性材料为电极,阴极发生还原反应,其电极反应式为Sb3++3e-=Sb;由“电解”中锑的产率与电压大小关系示意图可知,当电压超过U0V时,锑的产率降低,其原因可能是H+参与了电极反应。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案【题目】已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | K=1.77×10-4 | K=5.0×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
下列叙述错误的是
A. NaCN溶液中通人少量CO2发生的离子反应为:CN-+H2O+CO2=HCN+HCO3-
B. 等体积、等物质的量浓度的HCOONa和NaCN溶液中所含阴离子总数前者大于后者
C. 等物质的量浓度的NaHCO3和Na2CO3混合溶液中:c(Na+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
D. 中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者
【题目】氨气是重要化工原料,在国民经济中占重要地位。工业合成氨的反应为: N2(g)+H2(g)=2NH3(g) △H<0
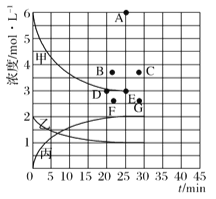
(1)右图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程的曲线图,t1、t3、t4 时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是___________(填写下列序号)

A.t1→t1 B.t2→t3 C.t3→t4 D.t5→t6
t4时改变的条件是________________。
进行如下研究:在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(2)该温度下,此反应的平衡常数K=____________。
(3)该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3mo/L、3mol/L、3mo/L,则此时V正_____V逆 (填">"“<”或“=”)。
(4)由上表中的实验数据计算得到“浓度一时间”的关系可用右图中的曲线表示,表示c(N2)-t的曲线是______。在此温度下,若起始充入4molN2和12 molH2,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_________。