题目内容
有五种摩尔质量均为44g/mol的化合物甲、乙、丙、丁、戊,均由短周期元素组成。对甲的捕获在降低温室气体排放中具有重要的作用。乙为烃,等物质的量的乙与丁充分燃烧产物为甲与水,且生成水的质量前者是后者的2倍,丙在一定条件下分解获得两种单质,两单质放电时反应生成A,A遇空气变成红棕色气体B。戊是一种极不稳定的物质,在1180℃以下不存在。科学家用质谱仪在工业制硅的反应产物中证实了其存在。
(1)丁的分子式 ,甲的电子式 。
(2)若生成戊的反应中氧化产物与还原产物为同一物质,写出生成戊的化学方程式 。
(3)把铁和铜混和物放入一定量B通入水后形成的稀溶液中,反应后过滤,滤出的固体物质投入盐酸中无气体放出,则滤液中一定含有的溶质是 。
(4)将0.2mol乙完全燃烧后生成的气体全部缓慢通入300mL某浓度的NaOH溶液中,气体完全被吸收,溶液中NaOH无剩余,则NaOH溶液的浓度为 (若有定值则写具体数值,无定值则写范围)。
(5)将等物质的量A、B的混合物溶于NaOH溶液中得到只含有一种溶质的溶液,此溶质的化学式为 ,设计简单实验方案证明溶液中含有此溶质 。
(1)C2H4O 
(2)Si+SiO2 2SiO
2SiO
(3)Fe(NO3)2
(4)3mol/L≤c(NaOH)≤4mol/L
(5)NaNO2,取少量溶液于试管中加入盐酸,试管口有棕红色气体产生证明有NaNO2,或其它正确答案(2分)
解析试题分析:摩尔质量均为44g/mol,化合物甲与温室气体联系在一起则是CO2;烃乙是C3H8;等物质的量的乙与丁充分燃烧产物为甲与水,且生成水的质量前者是后者的2倍,说明丁分子中有4g氢原子,含有氧原子,可知是C2H4O;丙在一定条件下分解获得两种单质,两单质放电时反应生成A,A遇空气变成红棕色气体B(NO2),可知丙有N和O元素组成,是N2O;戊是一种极不稳定的物质在工业制硅的反应产物中证实了其存在,说含有Si,是SiO2转化为Si的中间物,故是SiO。
(2)理解同一主族氧化物的相似性,C+CO2 2CO,即可写出生成戊的化学方程式。
2CO,即可写出生成戊的化学方程式。
(3)把铁和铜混和物放入一定量NO2通入水后形成的稀HNO3溶液中,反应后过滤,滤出的固体物质投入盐酸中无气体放出,固体是Cu,Fe只能氧化为Fe2+。
(4)将0.2mol C3H8完全燃烧后生成0.6molCO2,与碱反应,若生成Na2CO3需要1.2molNaOH;若生成NaHCO3需要0.6molNaOH,故300mLNaOH溶液的浓度为2mol/L≤c(NaOH)≤4mol/L。
(5)等物质的量NO、NO2的混合物可认为是N2O3,溶于NaOH溶液中得到一种溶质就是NaNO2。
考点:推断物质的分子式与物质的性质。

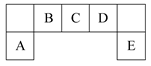
根据下列有关实验得出的结论一定正确的是
| 选项 | 方法 | 结论 |
| A | 同温时,等质量的锌粒分别与足量稀硫酸反应 | 产生氢气量:加过胆矾=没加胆矾 |
| B | 向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液,则溶液变黄 | 氧化性:H2O2>Fe3+ |
| C | 相同温度下,等质量的大理石与等体积、等浓度的盐酸反应 | 反应速率:粉状大理石>块状大理石 |
| D | 向2mL 0.1mol·L-1Na2S溶液中滴入几滴0.1mol·L-1ZnSO4溶液,有白色沉淀生成;再加入几滴0.1mol·L-1 CuSO4溶液,则又有黑色沉淀生成 | 溶度积(Ksp):ZnS>CuS |
稀土元素是周期表中Ⅲ B族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3。其中钇(Y)元素是激光和超导的重要材料。
我国蕴藏着丰富的钇矿石( Y2 FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下: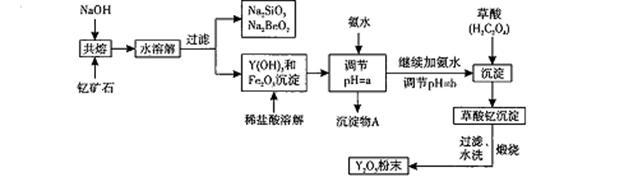
已知:
I.有关金属离子形成氢氧化物沉淀时的pH如下表:
| | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
Ⅱ.在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)钇矿石(Y2 FeBe2Si2O10)的组成用氧化物的形式可表示为 。
(2)欲从Na2 SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。则
①最好选用盐酸、 (填字母代号)两种试剂,再通过必要的实验操作方可实现。
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式: :必要的实验操作应是 。
(3)为使Fe3+沉淀完全,须用氨水调节pH =a,则a应控制在 的范围内;继续加氨
水调节pH =b发生反应的离子方程式为 ,溶液中Fe3+完全沉淀的判定标准是 。
(4)写出草酸钇[Y2(C2O4)3.Nh2O]煅烧的化学方程式 。