题目内容
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
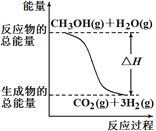
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH =+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
根据上述反应,下列说法正确的是( )
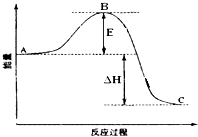
A. 右图表示反应①中的能量变化
B. 可推知2H2(g)+O2(g)=2H2O(g) ΔH=-483.8 kJ/mol
C. 1 mol CH3OH充分燃烧放出的热量为192.9 kJ
D. CH3OH转变成H2的过程一定要吸收能量
【答案】B
【解析】试题分析:A、反应①为吸热反应,反应物的总能量应该低于生成物的总能量,与题给图像不符,A错误;B、根据盖斯定律:(②—①)×2得2H2(g) + O2(g) = 2H2O(g),ΔH = -483.8 kJ/mol,B正确;C、没有明确乙醇和水的状态,无法确定1 mol CH3OH充分燃烧放出的热量,C错误;D、根据反应题给反应知CH3OH转变成H2的过程反应①为吸热反应,反应②为放热反应,D错误。答案选B。

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
【题目】下列除杂试剂选择正确的是
选项 | 待提纯物质 | 杂质 | 除杂试剂 |
A | Cl2 | HCl | NaOH溶液 |
B | CO2 | CO | O2 |
C | FeCl3溶液 | FeCl2 | Cl2 |
D | Na2CO3 | NaHCO3 | 盐酸 |
A. A B. B C. C D. D