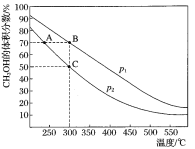
题目内容
【题目】某红色固体粉末可能是Fe2O3、Cu2O或二者混合物,为探究其组成,称取mg该固体粉末样品,用足量的稀H2SO4充分反应后,称得固体质量为ag。
已知:Cu2O+2H+ = Cu+Cu2++H2O
(1)若a=____________(用含m的最简式表示),则红色固体粉末为纯净物;
(2)若a=m/9,则红色固体粉末中Fe2O3的物质的量为____________mol(用含m的最简式表示)。
【答案】![]()
![]()
【解析】
(1)红色固体粉末为纯净物只有两种情况,全是Fe2O3或者全是Cu2O。Cu2O和硫酸反应生成的Cu会与Fe3+反应,Cu+2Fe3+=Cu2++2Fe2+。若全为Fe2O3时,剩余的固体物质为a=0g,但是当剩余固体质量为0g时,也有可能是Fe2O3和Cu2O两种物质的混合物;所以该红色固体只能为Cu2O。
Cu2O+2H+=Cu+Cu2++H2O
![]()
![]()
![]() ,所以a=
,所以a=![]() m
m
(2)设Fe2O3为 x mol, Cu2O为ymol,则160x+144y=m,Cu2O+2H+=Cu+Cu2++H2O得到的铜为ymol。
Cu+2Fe3+=Cu2++2Fe2+
x mol 2x mol
剩余的铜的质量为(y-x)×64=a=![]() m,方程式联立,解出x=
m,方程式联立,解出x=![]() 。
。

【题目】原电池是化学对人类的一项重大贡献。
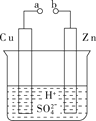
(1)某兴趣小组为研究电池原理,设计如图A装置。
|
|
A | B |
①a和b不连接时,烧杯中发生反应的离子方程式是___________________。
②a和b用导线连接,Cu极为原电池________(填“正”或“负”)极,该电极反应式是____________________________。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.4 mol电子,则理论上Zn片质量减轻________ g。
(2)如图B是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为________________。
②电池工作一段时间后电解质溶液的pH________(填“增大”“减小”或“不变”)。