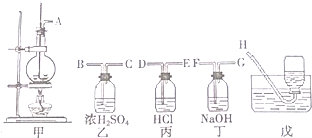
题目内容
9.现有X.Y.Z三种常见短周期元素,x的原子结构示意图为 Y、z为同周期金属元素,Y、Z的最高价氧化物对应水化物可以反应生成盐和水.回答下列问题:
Y、z为同周期金属元素,Y、Z的最高价氧化物对应水化物可以反应生成盐和水.回答下列问题:(1)已知Y2 X2为浅黄色固体物质,其阴阳离子个数比为1:2,其中含有的化学键类型有离子键、非极性键.
(2)将单质Z的薄片在酒精灯上加热至熔化,观察到的现象融化成的小球不落下,产生该现象的原因是氧化铝的熔点比铝高.
(3)Y、Z最高价氧化物对应的水化物混合反应生成盐和水的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
分析 X、Y、Z三种常见短周期元素,由于X的原子结构示意图可知a=2,故X为O元素;结合(1)Y2X2为浅黄色固体物质,可知Y为Na元素,Y、Z为同周期金属元素,二者的最高价氧化物对应水化物可以反应生成盐和水,为氢氧化钠与氢氧化铝反应,故Z为Al元素,据此进行解答.
解答 解:X、Y、Z三种常见短周期元素,由于X的原子结构示意图可知a=2,故X为O元素,结合(1)Y2 X2为浅黄色固体物质,可知Y为Na元素,Y、Z为同周期金属元素,二者的最高价氧化物对应水化物可以反应生成盐和水,为氢氧化钠与氢氧化铝反应,故Z为Al元素,
(1)Na2O2由钠离子与过氧根离子构成的离子化合物,其过氧根离子与钠离子的个数比为1:2;过氧根离子与钠离子之间形成离子键,过氧根离子中氧原子之间形成非极性键,
故答案为:1:2;离子键;非极性键;
(2)将单质Al的薄片在酒精灯上加热至熔化,由于反应生成氧化铝,氧化铝的熔点比铝高,氧化铝膜兜住铝箔融化成的小球不落下,
故答案为:融化成的小球不落下;氧化铝的熔点比铝高;
(3)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,正确推断各元素为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.下列物质的分类错误的是( )
| A. | 水、二氧化硫和干冰都属氧化物 | B. | H2SO4、HNO3和H2CO3都属于酸 | ||
| C. | KNO3、CuSO4和NH4Cl都属于盐 | D. | 烧碱、纯碱、熟石灰都属于碱 |
17.下列叙述不正确的是( )
| A. | CH3COOH与C6H5COOH为同系物 | |
| B. | 戊烷比丙烷的沸点高 | |
| C. | 烷烃的化学性质与甲烷类似,通常较稳定 | |
| D. | 用燃烧法可鉴别甲烷和乙烯 |
4.可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极.下列说法正确的是( )
| A. | 以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-═4OH- | |
| B. | 以NaOH溶液为电解液时,负极区域的现象:先生成白色沉淀后逐渐溶解 | |
| C. | 以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 | |
| D. | 电池工作时,电子通过外电路从正极流向负极 |
14.下列关于化学观或化学研究方法的叙述中,错误的是( )
| A. | 为防止水体富营养化.必须控制富含氮、磷污水的排放 | |
| B. | 在元素周期表的金属和非金属分界线附近寻找半导体材料 | |
| C. | 根据元索周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4 | |
| D. | 汽车尾气中产生NO的原因是空气中的N2与O2在汽车汽缸内的高温环境下发生反应产生的 |
1.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 2.4g Mg与N2完全反应,转移电子数都是0.3NA | |
| B. | 1mol白磷分子中含有P-P键数为1.5NA | |
| C. | 1.7gH2O2中含有的电子数为0.9NA | |
| D. | 在18g 18O2中含有2NA个氧原子 |
13.2014年5月7日南京某建设公司丢失用于材料探伤的放射源${\;}_{77}^{192}$Ir一枚,Ir是第Ⅷ族元素,下列关于${\;}_{77}^{192}$Ir的说法正确的是( )
| A. | ${\;}_{77}^{192}$Ir核外含有115个电子 | B. | Ir为非金属元素 | ||
| C. | ${\;}_{77}^{192}$Ir的中子数是115 | D. | ${\;}_{77}^{192}$Ir的质量数是77 |

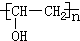 ;检验B常用的试剂为银氨溶液或新制氢氧化铜悬浊液;
;检验B常用的试剂为银氨溶液或新制氢氧化铜悬浊液;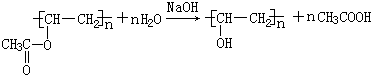 .
.