题目内容
(26分)按下图装置进行实验,并回答下列问题: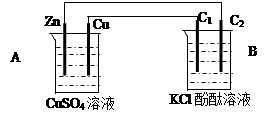
(1)判断装置的名称:A池为___________ ;B池为______________;
(2)锌极为________极,电极反应式为 ;
铜极为________极,电极反应式为 ;
石墨棒C1为______极,电极反应式为 ;
石墨棒C2附近发生的实验现象为 ;
(3)当C2极析出224mL气体(标准状态)时,锌的质量变化_________(变大、不变或变小)了________g,CuSO4溶液的质量_________(增加、不变或减少)_________g。
(1)原电池;电解池
(2)负极 Zn—2e-=Zn2+正极 Cu2++2e-=Cu
阳极 2Cl--2e-=Cl2↑ 溶液呈红色
(3)变小 0.65 增加 0.01
解析试题分析:(1)分析题给装置知,A为原电池,B为电解池;(2)A为原电池,金属活泼性较强的锌为负极,电极反应式为Zn-2e-=Zn2+;金属活泼性较弱的铜为正极,电极反应为:Cu2++2e-=Cu,石墨棒C1与原电池的正极相连为电解池的阳极,阳极上氯离子失电子生成氯气,电极反应式为:2Cl--2e-=Cl2↑;石墨棒C2与原电池的负极相连为电解池的阴极,电极反应式为2H++2e-=H2↑,阴极附近生成氢气和氢氧根离子,溶液呈变红;(3)石墨棒C2与原电池的负极相连为电解池的阴极,电极反应式为2H++2e-=H2↑,当C2极析出224mL气体(标准状态)时,生成氢气的物质的量为0.01mol,转移的电子为0.02mol,锌电极的方程式为:Zn-2e-=Zn2+,根据电子守恒可知,消耗的Zn为0.01mol,则锌的质量减少0.65g,生成铜的物质的量为0.01mol,质量为6.4g,硫酸铜溶液质量增加0.01g。
考点:考查原电池和电解池原理。

下列有关电池的说法不正确的是
| A.手机上用的锂离子电池属于二次电池 |
| B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
| C.甲醇燃料电池可直接把化学能转化为电能 |
| D.铅蓄电池充电时,阳极的反应为:PbSO4+2H2O-2e-=PbO2+SO42-+4H+ |
下图所示的装置中,有关说法不正确的是 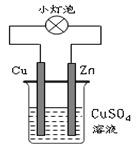
| A.该装置实现化学能转变为电能 |
| B.该装置中Cu2+向Zn电极移动 |
| C.该装置外电路中电子由Zn棒转移到Cu棒 |
| D.该装置中Zn棒上的电极反应为:Zn-2e-=Zn2+ |
电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72+6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确是
| A.阳极反应为Fe-2e- =Fe2+ |
| B.电解过程中溶液pH不会变化 |
| C.过程中有Fe(OH)3沉淀生成 |
| D.电路中每转移12 mol电子,最多有1 mol Cr2O72-被还原 |
某课外活动小组用如图所示装置进行实验(电解液足量)。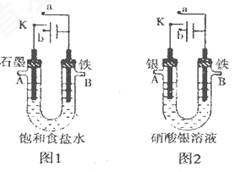
下列说法中错误的是
A.圈l中,若开始实验时开关K与a连接,则B极的电极反应式为 |
| B.图l中,若开始实验时开关K与b连接,则一段时间后向电解液中通入适量HCl气体可恢复到电解前的浓 |
| C.图2中,若开始实验时开关K与a连接,则电解液的溶质质量分数变小 |
| D.图2中,若开始实验时开关K与b连接,则A极减少 |
锂~碘电池可用来为心脏起搏器提供能源,其电池反应可表示为:2Li + I2 →2LiI。下列有关说法错误的是
| A.放电时化学能转化为电能 | B.负极反应为:Li –e→Li+ |
| C.正极反应为:I2+2e →2I- | D.电子由正极流向负极 |
镍氢电池比碳锌或碱性电池有更大的输出电流,更适合用于高耗电产品。镍氢电池的总反应式是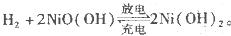 。下列叙述错误的是
。下列叙述错误的是
| A.电池充电时,氢元素被还原 |
| B.电池放电时,镍元素被氧化 |
| C.电池放电时,氢气在负极反应 |
| D.电池放电时,电池负极周围溶液的碱性减弱 |
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是 
| A.有O2放电的a极为电池的负极 |
| B.a极对应的电极反应为:O2+ 2H2O+ 4e--= 4OH- |
| C.有H2放电的一极电极反应为:H2+O2- -2 e- =H2O |
| D.该电池的总反应方程式为:2H2+ O2= 2H2O |
下列叙述的方法不正确的是 ( )
| A.金属的电化学腐蚀比化学腐蚀更普遍 |
| B.用铝质铆钉铆接铁板,铁板易被腐蚀 |
| C.钢铁在干燥空气中不易被腐蚀 |
| D.用牺牲锌块的方法来保护船身 |