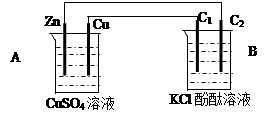题目内容
锂~碘电池可用来为心脏起搏器提供能源,其电池反应可表示为:2Li + I2 →2LiI。下列有关说法错误的是
| A.放电时化学能转化为电能 | B.负极反应为:Li –e→Li+ |
| C.正极反应为:I2+2e →2I- | D.电子由正极流向负极 |
D
解析试题分析:只有碘单质遇淀粉溶液变蓝。
考点:碘单质的鉴别。

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
某同学做完铜、锌稀硫酸原电池的实验后得出了下列结论,你认为正确的是
| A.构成原电池正极和负极的材料必须是两种金属 |
| B.当由铜、锌电极与硫酸铜溶液组成原电池时,铜是负极 |
| C.该实验电子沿导线由锌流向铜,氢离子得到电子而放出氢气 |
| D.铜锌原电池工作时,电流由锌经导线流向铜 |
下图所示原电池工作时,右池中Y2O72-转化为Y3+。下列叙述正确的是
| A.左池电极反应式:X4+ + 2e-=X2+ |
| B.每消耗1mol Y2O72-,转移3mol电子 |
| C.改变右池溶液的c(H+),电流强度不变 |
| D.左池中阴离子数目增加 |
用质量均为100g的铜作电极,电解硝酸银溶液(足量),电解一段时间后,两电极的质量差为28g,此时两电极的质量分别为( )
| A.阳极100g,阴极128g | B.阳极93.6g,阴极121.6g |
| C.阳极91.0g,阴极119.0g | D.阳极86.0g,阴极114.0g |
下列说法中正确的是( )
| A.锌锰干电池是二次电池 |
| B.铝片、锌片、导线和高橙组成的水果电池,负极是锌片 |
| C.锂电池的电解质可选择KOH溶液 |
| D.氢氧燃料电池工作时O2为正极,发生还原反应。 |
如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是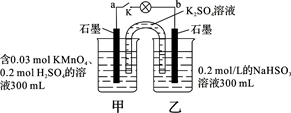
| A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的pH约为1 |
| B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a |
| C.电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小 |
| D.乙池中的氧化产物为SO42- |
根据下图实验装置判断,下列说法正确的是
| A.该装置能将电能转化为化学能 |
| B.活性炭为正极,其电极反应式为: 2H++2e-=H2↑ |
| C.电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔 |
| D.装置内总反应方程式为:4Al+3O2 +6H2O = 4Al(OH)3 |