题目内容
下图所示的装置中,有关说法不正确的是 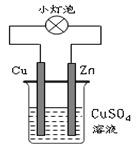
| A.该装置实现化学能转变为电能 |
| B.该装置中Cu2+向Zn电极移动 |
| C.该装置外电路中电子由Zn棒转移到Cu棒 |
| D.该装置中Zn棒上的电极反应为:Zn-2e-=Zn2+ |
B
解析试题分析:该装置为原电池装置。原电池是将化学能转变为电能的装置,在原电池中。较活泼的金属做负极,不活泼的金属或非金属做正极。负极失去电子发生氧化反应,失去的电子转移到正极,使正极附近集聚很多的电子,电子带负电,故能吸引电解质溶液中的阳离子,阳离子在正极附近得到电子,发生还原反应。所以在这个原电池的装置图中,我们知道锌做负极,铜做正极。电子的流动方向是负极流向正极即电子应由锌极流向铜极。电解质溶液中的铜离子应是向铜极移动。所以B选项是错误的
考点:考查原电池的相关知识

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下图为一原电池的结构示意图,下列说法中,错误的是 
| A.Cu电极为正电极 |
| B.原电池工作时,电子从Zn电极流出 |
| C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu |
| D.盐桥(琼脂-饱和KCl溶液)中的K+移向ZnSO4溶液 |
有M、N、P、Q四块金属片,进行如下实验:
①M、N用导线相连后,同时插入稀H2SO4中,M极为负极
②P、Q用导线相连后,同时浸入稀H2SO4中,电子由P→导线→Q
③M、P相连后,同时浸入稀H2SO4,P极产生大量气泡
④N、Q相连后,同时浸入稀H2SO4中,Q极发生氧化反应
则四种金属的活动性顺序为
| A.M>N>P>Q | B.M>P>Q>N | C.N>Q>P>M | D.P>M>N>Q |
下图所示原电池工作时,右池中Y2O72-转化为Y3+。下列叙述正确的是
| A.左池电极反应式:X4+ + 2e-=X2+ |
| B.每消耗1mol Y2O72-,转移3mol电子 |
| C.改变右池溶液的c(H+),电流强度不变 |
| D.左池中阴离子数目增加 |
下列关于写图所示原电池的叙述中,正确的是
| A.质量减轻的一极是铜极 |
| B.负极反应为Fe—2e→ Fe2+ |
| C.该装置将电能转变为化学能 |
| D.电流由负极经导线流向正极 |
下列说法中正确的是( )
| A.锌锰干电池是二次电池 |
| B.铝片、锌片、导线和高橙组成的水果电池,负极是锌片 |
| C.锂电池的电解质可选择KOH溶液 |
| D.氢氧燃料电池工作时O2为正极,发生还原反应。 |
已知:锂离子电池的总反应为:LixC+Li1-xCoO2 C+LiCoO2锂硫电池的总反应为:2Li+S
C+LiCoO2锂硫电池的总反应为:2Li+S Li2S
Li2S
有关上述两种电池说法正确的是
| A.锂离子电池放电时,Li+向负极迁移 |
| B.锂硫电池充电时,锂电极发生还原反应 |
| C.理论上两种电池的比能量相同 |
| D.右图表示用锂离子电池给锂硫电池充电 |