题目内容
【题目】某同学用软锰矿(主要含MnO2,还含有少了SiO2、Al2O3 、Fe2O3等杂质)模拟工业制高锰酸钾流程如下。试回答下列问题。
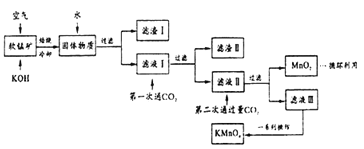
(1)配平焙烧时MnO2参与的化学反应:□MnO2+□_____+□O2 ![]() □K2MnO4+□H2O;第二次通入过量CO2时发生反应的离子方程式为:______________________。
□K2MnO4+□H2O;第二次通入过量CO2时发生反应的离子方程式为:______________________。
(2)滤渣I、II的成分中能与NaOH 反应的是__________________ (填化学式)。产生滤渣II时不能用稀盐酸代替CO2,因为______________________。
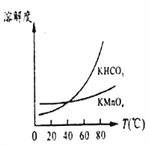
(3)将滤液Ⅲ进行一系列操作可得到KMnO4晶体。由下图可知,从滤液Ⅲ得到KMnO4需经过____、____洗涤等操作。
(4)用重结晶提纯的产品配制成0.10mol·L-1 的酸性KMnO4溶液来测定某草酸样品的纯度(杂质不参与反应,草酸为弱酸,分子式H2C2O4)。
①试给出反应的离子方程式:_______________________。
②若某测定大致共需要230毫升酸性KMnO4溶液,配制时所需玻璃仪器为:___、___烧杯、胶头滴管等。
③取草酸样品5 克,配成100mL溶液,取20mL于适当容器中,用前述所配酸性KMnO4溶液滴定,至反应结束消耗KMnO4溶液20mL,则样品的纯度为: ___________。
【答案】 2MnO2+4KOH+O2![]() 2K2MnO4+2H2O 3MnO42-+4CO2+2H2O=MnO2+2MnO4-+4HCO3- H2SiO3、Al(OH)3 盐酸会溶解Al(OH)3,使Al3+进入滤液产生杂质 蒸发结晶 趁热过滤 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O 250mL容量瓶 玻璃棒 45%
2K2MnO4+2H2O 3MnO42-+4CO2+2H2O=MnO2+2MnO4-+4HCO3- H2SiO3、Al(OH)3 盐酸会溶解Al(OH)3,使Al3+进入滤液产生杂质 蒸发结晶 趁热过滤 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O 250mL容量瓶 玻璃棒 45%
【解析】在加热以及空气的作用下二氧化锰与氢氧化钾反应生成锰酸钾和,二氧化硅、氧化铝也均与氢氧化钾反应生成偏铝酸钾和硅酸钾,氧化铁不反应,所得固体物质用水溶解后得到滤渣Ⅰ是氧化铁;滤液Ⅰ中通入二氧化碳生成氢氧化铝和硅酸沉淀,即滤渣Ⅱ是氢氧化铝和硅酸;滤液Ⅱ中通入二氧化碳后锰酸钾发生自身的氧化还原反应生成二氧化锰和高锰酸钾,则
(1)反应中Mn元素从+4价升高到+6价,失去2个电子,1分子氧气得到4个电子,根据电子得失守恒以及原子守恒可知配平后的方程式为2MnO2+4KOH+O2![]() 2K2MnO4+2H2O;根据以上分析可知第二次通入过量CO2时发生反应的离子方程式为3MnO42-+4CO2+2H2O=MnO2+2MnO4-+4HCO3-。(2)滤渣I、II的成分中能与NaOH反应的是H2SiO3、Al(OH)3。由于盐酸是强酸,会溶解Al(OH)3,使Al3+进入滤液产生杂质,因此产生滤渣II时不能用稀盐酸代替CO2。(3)由下图可知碳酸氢钾的溶解度受温度影响大于高锰酸钾,所以从滤液Ⅲ得到KMnO4需经过蒸发结晶、趁热过滤、洗涤等操作。(4)①反应中Mn元素化合价从+7价降低到+2价,得到5个电子,碳元素化合价从+3价升高到+4价,失去1个电子,所以根据电子得失守恒、原子守恒以及电荷守恒可知反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。②没有230mL容量瓶,则配制时所需玻璃仪器为250mL容量瓶、玻璃棒、烧杯、胶头滴管等。③消耗高锰酸钾是0.002mol,根据方程式可知参加反应的草酸是0.005mol,因此样品的纯度为
2K2MnO4+2H2O;根据以上分析可知第二次通入过量CO2时发生反应的离子方程式为3MnO42-+4CO2+2H2O=MnO2+2MnO4-+4HCO3-。(2)滤渣I、II的成分中能与NaOH反应的是H2SiO3、Al(OH)3。由于盐酸是强酸,会溶解Al(OH)3,使Al3+进入滤液产生杂质,因此产生滤渣II时不能用稀盐酸代替CO2。(3)由下图可知碳酸氢钾的溶解度受温度影响大于高锰酸钾,所以从滤液Ⅲ得到KMnO4需经过蒸发结晶、趁热过滤、洗涤等操作。(4)①反应中Mn元素化合价从+7价降低到+2价,得到5个电子,碳元素化合价从+3价升高到+4价,失去1个电子,所以根据电子得失守恒、原子守恒以及电荷守恒可知反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。②没有230mL容量瓶,则配制时所需玻璃仪器为250mL容量瓶、玻璃棒、烧杯、胶头滴管等。③消耗高锰酸钾是0.002mol,根据方程式可知参加反应的草酸是0.005mol,因此样品的纯度为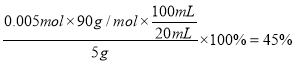 。
。

