题目内容
13.氮可以形成多种离子,如N3-、NH2-、N3-、NH4+、N2H5+、N2H6+等.已知N2H5+的形成过程类似于NH4+的形成过程,N2H5+在碱性溶液中将生成电中性的分子和水.试写出:(1)该电中性分子的化学式:N2H4;
(2)N2H5+的电子式:
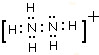 ;
;(3)1mol N3-共有22mol 电子;
(4)写出两种非金属氧化物跟N3-电子数相同的物质的化学式CO2、N2O.
分析 (1)微粒显示电中性即不带电荷的微粒,根据微粒符号来回答;
(2)N2H5+的内部氮原子和氢原子之间存在极性共价键,根据电子式的书写知识来回答;
(3)阴离子的电子数等于核内质子数和电荷数之和;
(4)根据分子的电子数等于构成分子的各个原子核外电子数之和知识来书写.
解答 解:(1)微粒显示电中性即不带电荷的微粒,根据给定的微粒符号,电中性的分子化学式为:N2H4,故答案为:N2H4;
(2)N2H5+的内部氮原子和氢原子之间存在极性共价键,电子式为: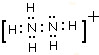 ;故答案为:
;故答案为: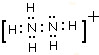 ;
;
(3)1mol N3-共有(3×7+1)mol=22mol电子;故答案为:22;
(4)1mol N3-共有(3×7+1)mol=22mol电子,非金属氧化物跟N3-电子数相同的物质的化学式:CO2、N2O,故答案为:CO2;N2O.
点评 本题考查了氮元素形成的多种离子,根据微粒的核外电子数的计算方法来分析,侧重于考查学生对知识的迁移能力,题目难度中等.

练习册系列答案
相关题目
3.能正确表示下列反应的离子方程式是( )
| A. | 碳酸钙溶于醋酸CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 锌片插入硝酸银溶液中Zn+Ag+═Zn2++Ag | |
| C. | 在稀氨水中通入过量CO2:NH3•H2O+CO2═NH4++HCO3- | |
| D. | 硫酸镁溶液和氢氧化钡溶液反应 SO42-+Ba2+═BaSO4↓ |
4.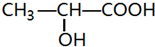 有机物甲的结构简式如图所示,利用该物质为原料制成的高分子材料乙具有生物兼容性.下列关于甲、乙的判断,错误的是( )
有机物甲的结构简式如图所示,利用该物质为原料制成的高分子材料乙具有生物兼容性.下列关于甲、乙的判断,错误的是( )
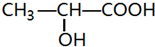 有机物甲的结构简式如图所示,利用该物质为原料制成的高分子材料乙具有生物兼容性.下列关于甲、乙的判断,错误的是( )
有机物甲的结构简式如图所示,利用该物质为原料制成的高分子材料乙具有生物兼容性.下列关于甲、乙的判断,错误的是( )| A. | 甲能与碳酸氢钠溶液发生反应 | |
| B. | 1mol甲能与2molNaOH反应 | |
| C. | 一定条件下,甲可发生酯化反应 | |
| D. | 由甲为原料制成高分子材料乙的反应不是加聚反应 |
1.二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2是一种橙黄色液体,遇水易水解,产生能使品红褪色的气体,且溶液变浑浊.下列说法正确的是( )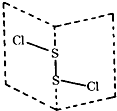

| A. | S2Cl2的分子中各原子最外层都为8电子结构 | |
| B. | S2Cl2是氧化剂,水是还原剂 | |
| C. | 将反应后所得的溶液滴入碳酸氢钠溶液中有气泡产生 | |
| D. | 反应中,生成1mol气体,转移电子为2mol |
8.下面有关电化学的图示,完全正确的是( )
| A. |  Cu-Zn原电池 | B. | 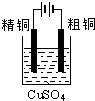 粗铜的精炼 | C. | 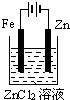 铁片镀锌 | D. | 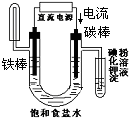 电解产物 |
18.汽车尾气无害化处理反应为2NO(g)+2CO(g)═N2(g)+2CO2(g).下列说法错误的是( )
| A. | 升高温度可使该反应的正逆反应速率同时增大 | |
| B. | 单位时间内消耗CO和NO的物质的量相等时,反应达到平衡 | |
| C. | 反应达到平衡后,NO的反应速率保持恒定 | |
| D. | 使用高效催化剂可增大反应速率 |
5.2013年1月全国近二十个省区市遭遇雾霾天气,雾霾天气影响着人们的生活和生命安全.汽车排放的尾气是造成雾霾的因素之一.“减少污染源,削减大气污染物是解决雾霾的根本之道.”下列措施不能达到“减少污染源”目的是( )
| A. | 利用潮汐能电解水制氢气 | B. | 大力推广乙醇汽油燃料汽车 | ||
| C. | 利用甲烷制造燃料电池 | D. | 提倡化石燃料燃烧 |
2.已知2SO2+O2?2SO3为放热反应,对该反应的下列说法中正确的是( )
| A. | SO2和O2的总能量一定高于SO3的总能量 | |
| B. | O2的能量一定高于SO2的能量 | |
| C. | SO2和O2的总能量一定低于SO3的总能量 | |
| D. | 因该反应为放热反应,故不必加热就可发生 |
3.下列物质中,属于电解质的是( )
| A. | 石灰水 | B. | Cu | C. | NaCl | D. | 蔗糖 |