题目内容
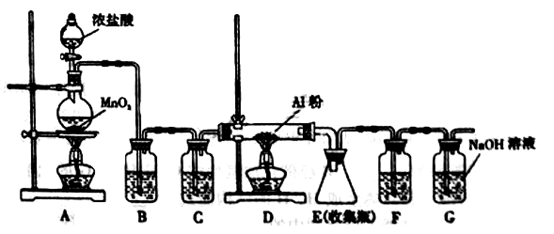
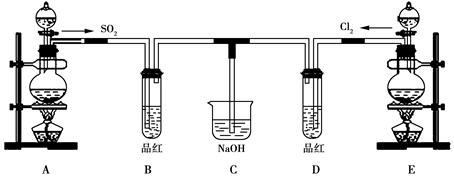
今有下列气体:H2、Cl2、CH4、HCl、NH3、NO、H2S、SO2,用如图装置进行实验,填写下列空白:
(1)当烧瓶干燥时,从A口进气可收集的气体是_____,从B口进气可收集的气体是____。
(2)当烧瓶中充满水时,可用来测量____等气体的体积。
(3)当烧瓶中装入某种溶液,用于洗气时,气体应从____口进入烧瓶。
(1)H2、CH4、NH3 Cl2、HCl、H2S、SO2
(2)H2、CH4、NO (3)B
解析

工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为___________;
②硫酸钠和焦炭、石灰石反应的化学方程式为_________(已知产物之一为CaS);
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
| | |
| |  |
②装置乙中发生反应的化学方程式为_______;
(3)联合制碱法对氨碱法的改进,其优点是______________;
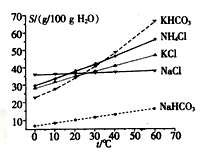
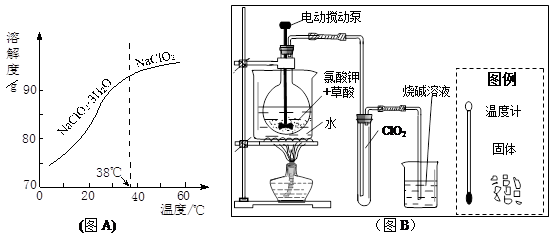
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?__________。
过碳酸钠(Na2CO3·3H2O2),有固体双氧水的俗称,该晶体具有Na2CO3和H2O2的双重性质,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,过碳酸钠的某生产流程如下图所示。
已知:2Na2CO3+3H2O2=2Na2CO3·3H2O △H<0;回答下列问题: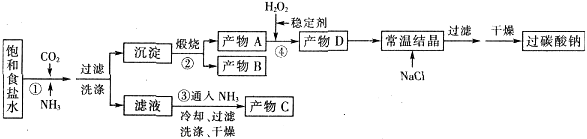
(1)下列物质可使过碳酸钠较快失效的是(填序号)_________。
| A.FeCl3溶液 | B.H2S | C.稀硫酸 | D.NaHCO3溶液 |
(3)在上述流程中,向反应前的H2O2中加入稳定剂的作用是____________________。
(4)该生产流程中可循环使用的物质是______________________________(填化学式)。
(5)生产过碳酸钠的流程中遗漏了一步,造成所得产品纯度偏低,请简述该步操作过程___________。
(6)实验室利用下图装置制备过碳酸钠,该装置中恒压滴液漏斗中支管的作用是_______,冷凝管应从__________处进水。
(7)由实验测定反应温度对产物的影响如下表:根据下表数据,你认为反应最佳的温度选择的范围是_______________。
| T/℃ | 活性氧百分含量 | 产率 |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |
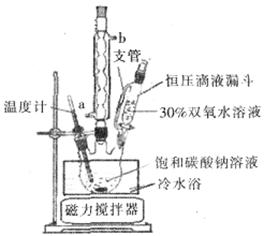 、
、 (12分)氯酸钾热分解是实验室制取氧气的一种方法,某探究小组查阅资料得知,氯酸钾在不同条件下分解结果如下:
| 实验 | 反应体系 | 第一放热峰温度(℃) | 第二放热峰温度(℃) |
| l | KC1O3 | 400(无气体放出) | 480(有少量气体放出) |
| 2 | KC1O3+MnO2 | 350(有大量气体放出) | |
 KCl+2O2↑,请写出在400℃的化学反应方程式 (提示:反应中只有氯元素的化合价改变)。
KCl+2O2↑,请写出在400℃的化学反应方程式 (提示:反应中只有氯元素的化合价改变)。该小组同学利用实验2来制取氧气时,在实验中发现生成的气体略带颜色、并有刺激性气味。
【提出问题】实验中生成的气体中除了氧气外还含有什么物质?
【查阅资料】1.二氧化氯常温下是黄色有强烈刺激性气味的气体
2.二氧化氯具有强氧化性,在溶液中能够把二价锰氧化成四价锰,使之形成不溶于水的二氧化锰(2ClO2+5Mn2++6H2O=5MnO2↓+12H++2Cl—),而氯气不能。
【提出假设】假设l:含有氯气;假设2:含有二氧化氯。
【设计实验】甲同学设计实验验证假设1成立。
| 实验步骤 | 实验现象 | 实验结论 |
| 将产生的气体接触湿润的淀粉碘化钾试纸 | | 假设l正确 |
| 实验步骤 | 实验现象 | 实验结论 |
| | | 假设2正确 |
(16分)化学实验是科学探究的基础。请回答有关实验问题:
(1)下面的四个实验装置有三个都存在明显缺陷,其中完全正确的是 :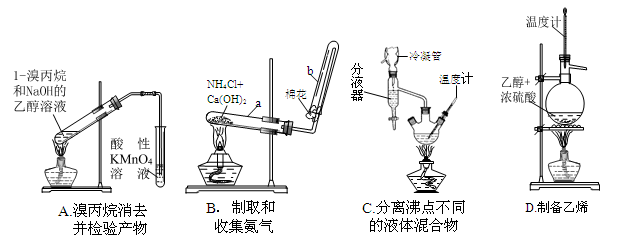
(2)要检验上面B装置氨气已集满的操作是 则试管已集满。
(3)ClO2是一种安全、高效、广谱、强力杀菌剂,其性质如右表:
| 色态 | 溶于碱 | 超过1Kpa、受热或遇光 | |
| 常温气体 | -59-11℃红黄色液体 | 生成亚氯酸盐和氯酸盐 | 爆炸 |
②工业用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图B所示装置模拟工业制法制取并收集液态ClO2,请模仿下图B的装置图和图例,在答题卡的相应图中补充完善装置图,并作必要的标注。
某研究小组在实验室中用铜粉(含铁粉5%以上)制取胆矾(CuSO4·5H2O)并检验其纯度,限选试剂:3 mol·L-1H2SO4溶液、浓硝酸、3%H2O2溶液、0.2 mol·L-1NaOH溶液、20% KSCN溶液、BaCl2溶液。有关物质溶解度如下表(单位g/100 g H2O):
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| CuSO4 | 14.3 | 20.7 | 28.5 | 40.0 | 55.0 | 75.4 |
| Cu(NO3)2 | 81.8 | 124.8 | 163.1 | 181.8 | 207.8 | 247.3 |
(1)完成制取胆矾的实验方案。
| 实验步骤 | 预期现象 |
| 步骤1:除铁。将铜粉置于烧杯中,__________________ | _______________________ |
| 步骤2:溶解。将步骤1得到的铜粉置于烧杯中, __________________________ | _______________________ |
| 步骤3:结晶。将步骤2所得溶液蒸发浓缩至液面有晶膜出现,冷却至室温,过滤得粗产品 | |
(2)完成步骤1后,检验铜粉中的铁是否除尽的实验操作是___________。
(3)若胆矾中含有少量Cu(NO3)2·3H2O,测定其中CuSO4·5H2O的含量,实验步骤如下:称量胆矾样品的质量为m1,加水溶解,滴加足量BaCl2溶液,充分反应后过滤,将滤渣烘干、冷却,称得其质量为m2。样品中CuSO4·5H2O的质量分数为________(列出算式)。
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O

 ________Cu+________CO2↑+________H2O
________Cu+________CO2↑+________H2O