题目内容
(16分)化学实验是科学探究的基础。请回答有关实验问题:
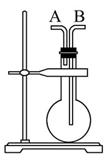
(1)下面的四个实验装置有三个都存在明显缺陷,其中完全正确的是 :
(2)要检验上面B装置氨气已集满的操作是 则试管已集满。
(3)ClO2是一种安全、高效、广谱、强力杀菌剂,其性质如右表:
| 色态 | 溶于碱 | 超过1Kpa、受热或遇光 | |
| 常温气体 | -59-11℃红黄色液体 | 生成亚氯酸盐和氯酸盐 | 爆炸 |
②工业用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图B所示装置模拟工业制法制取并收集液态ClO2,请模仿下图B的装置图和图例,在答题卡的相应图中补充完善装置图,并作必要的标注。

(1)(2分)B(2分) (2)(2分)取用水湿润的pH试纸(或红色石蕊试纸,或粘有浓氨水的玻棒)靠近b管口(1分),若试纸变红(或有白烟,1分)) (3)(12分)① 低温避光(2分)
ClO2+2OH-=ClO2-+ClO3-+H2O(2分) 略高于(或大于)38℃(2分) 减压蒸发(2分。说明:从溶解度曲线可以看出,常压在略高于38℃时蒸发留在母液中的NaClO2太多,只有减压时蒸发,在略高于38℃时水分挥发多一些、母液少一些。若答为38-60℃或之间的数值给1分)
②(见右图)其中画出温度计位置正确1分、标注1分,画出烧怀和冰(或冰水)1分、标注1分。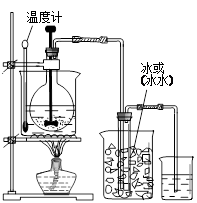
解析试题分析:(1)A、乙醇易挥发,挥发出的乙醇也能被酸性高锰酸钾溶液氧化而褪色,因此不能说明溴丙烷发生消去反应并检验产物,A不正确;B、熟石灰与氯化铵在加热的条件下反应生成氨气,氨气密度小于空气可用向下排空气法收集,B正确;C、分馏时温度计水银球应该放在蒸馏烧瓶支管出口处,C不正确;D、实验室制备乙烯时需要控制溶液的温度为170℃,温度计应该放在溶液中,D不正确,答案选B。
(2)氨气是碱性气体,因此要检验上面B装置氨气已集满的操作是取用水湿润的pH试纸(或红色石蕊试纸,或粘有浓氨水的玻棒)靠近b管口,若试纸变红(或有白烟))则试管已集满。
(3)①由右表可以看出二氧化氯受热或遇光易爆炸,因此保存液态ClO2的条件是密封、低温避光;二氧化氯与碱反应生成亚氯酸盐和氯酸盐,因此ClO2与碱反应的离子方程式为ClO2+2OH-=ClO2-+ClO3-+H2O;由于二氧化氯超过1Kpa时受热或遇光易爆炸,因此控制条件是减压蒸发;观察右下“图A”可知温度低于38℃时析出的晶体含有结晶水,且溶解度随温度的升高而增大,所以要从NaClO2溶液制得不含结晶水的晶体,应控制析出晶体的温度范围是略高于(或大于)38℃。
(4)由题给信息可知,温度过高,二氧化氯的水溶液有可能爆炸,应降低反应温度,温度低于100℃的水浴加热应用温度计控制温度,为防止在较高温度下发生爆炸,且在-59-11℃时二氧化氯呈红黄色液体,因此应用冷水吸收,则正确的装置图为(见答案)。
考点:考查化学实验据此以及物质制备实验方案设计

 阅读快车系列答案
阅读快车系列答案化学小组采用类似制乙酸乙酯的装置(如下图),用环己醇制备环己烯。
已知:
| | 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |

(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片(防止爆沸),缓慢加热至反应完全,在试管C内得到环己烯粗品。
①导管B除了导气外还具有的作用是________。
②试管C置于冰水浴中的目的是______________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用________(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液

②再将环己烯按上图装置蒸馏,冷却水从________口进入(填“g”或“f”)。蒸馏时要加入生石灰,其目的是_____________________________________。
③收集产品时,控制的温度应在________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是________。
A.蒸馏时从70 ℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是________。
A.分别加入酸性高锰酸钾溶液
B.分别加入用金属钠
C.分别测定沸点
无水氯化亚铁用于制造铁系催化剂、印染的媒染剂和染料还原剂,还可用于冶金、医药、照相等行业。一实验小组模仿工业方法制取氯化亚铁,设计装置如下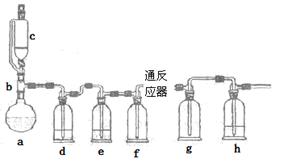
通过查阅相关资料可知:
①在持续高温500℃时,铁与纯净、干燥Cl2反应可生成FeCl2,在温度较低时可生成FeCl3;
②FeCl3熔沸点低,易升华。
根据以上信息回答相关的问题
(1)abc仪器组合成制取氯气的装置,反应无需加热,请写出a容器内所发生的化学反应方程式 。
(2)d、e盛装的药品分别是 和 ,f、g的作用是 。
(3)反应器为硬质玻璃管,纯净铁粉与氯气在500℃左右反应。
①化学反应方程式为
②实验操作顺序是:组装仪器、 、装入药品、 、 、停止加热、关闭c的活塞。
(4)实验小组记录的实验现象如下:
| | 观察到的部分现象 |
| 第一次实验 | 反应器中有白雾、红色固体、g瓶有白雾和黄绿色气体 |
| 第二次实验 | 反应器中有绿色晶体,g瓶有红棕色的烟和黄绿色气体 |
| 第三次实验 | 反应器中有绿色晶体,g瓶有黄绿色气体 |
①第一次实验,发现e瓶没有盛装任何药品,所以得到红色固体,其原因是 。
②第二次实验,g瓶有红棕色的烟,其原因是 。
(5)第三次实验得到的固体,最可能含有微量杂质是 ,如果需要配制约2~3mol/L的染料还原剂溶液,则无需除去,理由是 。
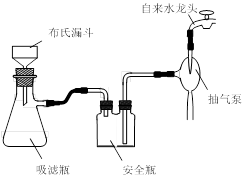
可用如图所示装置制取、净化、收集的气体是
| A.锌和稀硝酸反应制一氧化氮 |
| B.亚硫酸钠与浓硫酸反应制二氧化硫 |
| C.铁和稀硫酸反应制氢气 |
| D.浓氨水和生石灰反应制取氨气 |
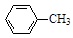 + 2KMnO4
+ 2KMnO4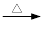
 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O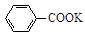 + HCl
+ HCl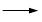
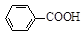 +KCl
+KCl

 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的基本操作流程如下: