题目内容
过碳酸钠(Na2CO3·3H2O2),有固体双氧水的俗称,该晶体具有Na2CO3和H2O2的双重性质,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,过碳酸钠的某生产流程如下图所示。
已知:2Na2CO3+3H2O2=2Na2CO3·3H2O △H<0;回答下列问题: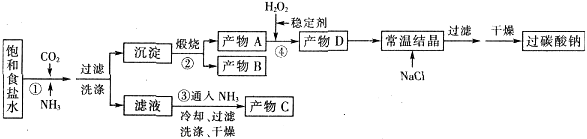
(1)下列物质可使过碳酸钠较快失效的是(填序号)_________。
| A.FeCl3溶液 | B.H2S | C.稀硫酸 | D.NaHCO3溶液 |
(3)在上述流程中,向反应前的H2O2中加入稳定剂的作用是____________________。
(4)该生产流程中可循环使用的物质是______________________________(填化学式)。
(5)生产过碳酸钠的流程中遗漏了一步,造成所得产品纯度偏低,请简述该步操作过程___________。
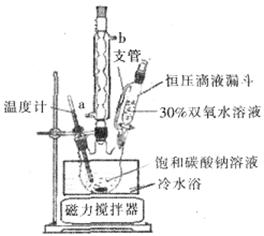
(6)实验室利用下图装置制备过碳酸钠,该装置中恒压滴液漏斗中支管的作用是_______,冷凝管应从__________处进水。
(7)由实验测定反应温度对产物的影响如下表:根据下表数据,你认为反应最佳的温度选择的范围是_______________。
| T/℃ | 活性氧百分含量 | 产率 |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |
 、
、
(1)ABC(3分) (2)NH3(2分) (3)防止双氧水分解(2分) (4)CO2(2分)
(5)沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作数次(2分) (6)使液体顺利流下;a(2分) (7)15~20℃(2分)
解析试题分析:(1)过碳酸钠(Na2CO3·3H2O2)具有Na2CO3和H2O2的双重性质,则A、FeCl3溶液能与碳酸钠反应,因此氯化铁也与过碳酸钠反应,A正确;B.H2S与双氧水发生氧化还原反应,则也与过碳酸钠发生氧化还原反应,B正确;C.稀硫酸与碳酸钠反应,因此也与过碳酸钠反应,C正确;D.NaHCO3溶液与碳酸钠以及双氧水等均不反应,因此也与过碳酸钠不反应,D不正确,答案选ABC。
(2)二氧化碳在水中的溶解度很小,而氨气极易溶于水,所以反应①应先通入的气体是氨气。
(3)由于双氧水稳定性差,易分解,因此向反应前的H2O2中加入稳定剂的作用是防止双氧水分解。
(4)碳酸氢钠分解生成碳酸钠、水和二氧化碳,即A是碳酸钠,B是二氧化碳,因此该生产流程中可循环使用的物质是CO2。
(5)从溶液中过滤出固体后,需要洗涤沉淀,因此该步操作是沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作数次。
(6)恒压滴液漏斗能保持压强恒定,因此恒压滴液漏斗中支管的作用是使液体顺利流下。冷凝管应从下端进水,即a处进水上端出水。
(7)根据下表数据可知温度超过20℃后,活性氧百分含量和产率均降低,所以反应最佳的温度选择的范围是15~20℃。
考点:考查物质制备实验流程的 分析与判断以及反应条件选择等

 名校课堂系列答案
名校课堂系列答案同一种制备装置可用于制取不同的气体,若只用如图装置制取气体,则: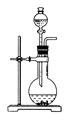
(1)请在下表空格中填上所需药品。
| 所制气体 | 药品 | |
| 分液漏斗内 | 烧瓶中 | |
| O2 | | MnO2 |
| H2 | 稀H2SO4 | |
| NH3 | | CaO |
| NO | 稀HNO3 | Cu |
| CO2 | 稀H2SO4 | 石灰石 |
| C2H4 | C2H5OH | 稀H2SO4 |
| C2H2 | | CaC2 |
(2)写出表中药品制备O2的化学方程式 。
(3)写出表中药品制备C2H2的化学方程式 。
(4)请画出干燥NH3的装置图,并标明干燥剂和气体流向。
(5)表中给全药品的项目中,不能用于制备相应气体的有(可不填满)。
①气体 ,理由 。
②气体 ,理由 。
③气体 ,理由 。
(14分)曾经有一种固氮的方法:1100°C通N2和CaC2反应得到CaCN2 。
已知:CaCN2+3H2O = 2NH3+CaCO3;CaC2+2H2O = C2H2↑+Ca(OH)2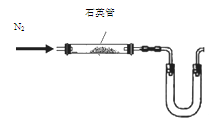
(1)某同学采用以下装置(加热和夹持仪器已略去)制取少量的CaCN2
①U形管中盛放的物质是 (填一种);
② (填“能”或“不能”)用普通玻璃管代替图中石英管;
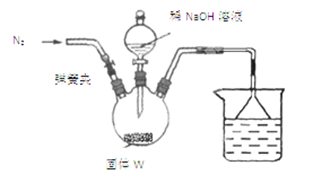
(2)检验反应后的固体(用W表示)中含有氮元素该同学将适量W溶于水,有气泡产生,说明固体中含有氮元素,该结论不正确。若要得出正确结论,还需进行的实验是 。
(3)测定W中CaCN2的质量分数
步骤Ⅰ:按如图所示装置(夹持仪器已略去)进行实验:关闭弹簧夹,将漏斗中溶液逐滴加入到三颈瓶中,当W反应完全后,打开弹簧夹,通入氮气,直至氨气被200mL0.1 mol·L-1硫酸完全吸收。
步骤Ⅱ:准确量取烧杯中溶液20.00mL置于锥形瓶中,滴入几滴指示剂,用cmol·L-1NaOH溶液滴定过量的硫酸,实验测得消耗标准溶液的平均体积为vmL。
已知三种常用指示剂变色pH范围如下:
| 指示剂 | a | b | c |
| 变色pH范围 | 3.1~4.4 | 8.0~10.0 | 4.4~6.2 |
| 说明 | pH<3.1显红色 pH>4.4显黄色 | pH<8.0显无色 pH>10.0显红色 | pH<4.4显红色 pH>6.2显黄色 |
②烧杯中最终吸收氨气的物质的量为 mol;经进一步计算可求得W中CaCN2质量分数。
③上述实验所得结果明显偏小,若不考虑装置的气密性和操作误差,则导致结果偏小的可能原因是
(写1种)。
 Ca2++
Ca2++
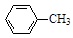 + 2KMnO4
+ 2KMnO4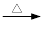
 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O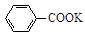 + HCl
+ HCl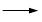
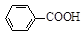 +KCl
+KCl

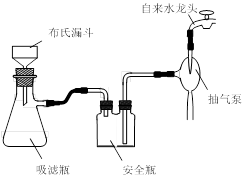
 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的基本操作流程如下: