题目内容
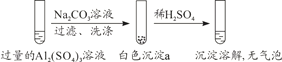
【题目】某学生探究0.25 mol·L-1 Al2(SO4)3溶液与0.5 mol·L-1 Na2CO3溶液的反应,实验如下。下列分析错误的是
实验1 |
|
实验2 |
|
A. 实验1中,白色沉淀a是Al(OH)3
B. 实验2中,白色沉淀b中含有CO![]()
C. 检验白色沉淀a、b是否洗涤干净,不可使用相同的检验试剂
D. 实验1、2中,白色沉淀成分不同可能与混合后溶液的pH有关
【答案】C
【解析】
实验1在过量的硫酸铝溶液中加入碳酸钠溶液,过滤、洗涤,得到沉淀a,加入稀硫酸,沉淀溶解,没有气泡,说明沉淀a中含有Al(OH)3。
实验2在过量的碳酸钠溶液中加入硫酸铝溶液,过滤、洗涤,得到沉淀b,加入稀硫酸,沉淀溶解,并有少量气泡,说明沉淀b中含有Al(OH)3,同时含有碳酸盐。
A.由以上分析可知,实验1中白色沉淀a是Al(OH)3,故A项正确;
B.实验2中有气泡生成,该气体为二氧化碳,可说明白色沉淀b含有CO32-,故B项正确;C.最后溶液中均含有硫酸根离子,检验沉淀是否洗涤干净,都可通过检验硫酸根离子的方法,即用盐酸酸化的BaCl2溶液,观察是否有白色沉淀生成,故C项错误;
D.实验1、2中,加入试剂的顺序不同,溶液的pH不同,生成的沉淀不同,说明白色沉淀的成分与溶液的pH有关,故D项正确。
答案选C。

【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060