题目内容
【题目】氨基乙酸(H2NCH2COOH)是蛋白质的水解产物之一,1 mol 的氨基乙酸中含有( )
A.2 mol氧气分子
B.12 mol氢原子
C.6.02×1023个H+
D.6.02×1023个氨基乙酸分子
【答案】D
【解析】
A.分子由原子构成,氨基乙酸分子中含有氧原子,不含氧分子,故A错误;
B. 1个氨基乙酸(H2 NCH2COOH)分子中含有5个H原子,1 mol 的氨基乙酸中含有5 mol氢原子,故B错误;
C.氨基乙酸(H2NCH2COOH)是共价化合物,H2NCH2COOH 不含H+,故C错误;
D.氨基乙酸由分子构成, 1 mol 的氨基乙酸中含有6.02×1023个氨基乙酸分子,故D正确;
选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案
相关题目
【题目】在某无色酸性溶液中能大量共存的一组离子是
A.Na+、K+、HCO3、NO3 B.NH4+、SO42、Al3+、NO3
C.Na+、Ca2+、NO3、CO32 D.K+、MnO4、NH4+、NO3
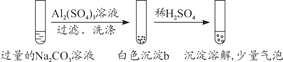
【题目】某学生探究0.25 mol·L-1 Al2(SO4)3溶液与0.5 mol·L-1 Na2CO3溶液的反应,实验如下。下列分析错误的是
实验1 |
|
实验2 |
|
A. 实验1中,白色沉淀a是Al(OH)3
B. 实验2中,白色沉淀b中含有CO![]()
C. 检验白色沉淀a、b是否洗涤干净,不可使用相同的检验试剂
D. 实验1、2中,白色沉淀成分不同可能与混合后溶液的pH有关