题目内容
【题目】铝是地壳中含量最多的金属元素,在自然界主要以化合态形式存在于氧化铝中,铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,冶炼金属铝很重要的一个过程是Al2O3的提纯。工业流程如下:
(1)试剂X应选择______(填标号)。
A.过量NaOH溶液 B.过量稀盐酸 C.过量FeCl3溶液
(2)若在实验室进行过滤操作,必须用到的玻璃仪器除了烧杯,还有_________;
(3)滤渣A和B的主要成份分别为_____、______;
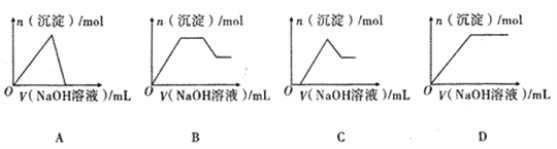
(4)若②中逐滴滴加NaOH溶液,则实验过程中产生沉淀的物质的量与加入NaOH溶液的体积之间的关系图正确的是_______;(填标号)
(5)③中与NaOH溶液反应的离子方程式为__________;
(6)④中发生反应的化学方程式为______________。
【答案】B 漏斗和玻璃棒 二氧化硅 氢氧化铁 C HCO3-+OH-=CO32-+H2O 2Al(OH)3![]() Al2O3+H2O
Al2O3+H2O
【解析】
铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,步骤①用盐酸溶解,发生反应:Al2O3+6H+=2Al3++3H2O,Fe2O3+6H+=2Fe3++3H2O,过滤得到滤渣A中含有SiO2,滤液中含Fe3+、Al3+,向该滤液中加入过量的NaOH溶液,Al3+反应生成NaAlO2溶液,Fe3+形成Fe(OH)3沉淀,过滤,Fe(OH)3进入滤渣B中,向滤液中再通入过量的二氧化碳气体,NaAlO2发生反应生成Al(OH)3的沉淀,将Al(OH)3灼烧生成Al2O3,最后电解熔融的Al2O3得到铝单质,以此解答该题。
由以上分析可知:
(1)试剂X是稀盐酸,故合理选项是B;
(2)若在实验室进行过滤操作,必须用到的玻璃仪器除了烧杯,还有漏斗、玻璃棒;
(3)根据上述分析可知滤渣A主要成分是SiO2;滤渣B的主要成分是Fe(OH)3;
(4)在②是溶液在含有过量HCl、AlCl3、FeCl3,向其中逐滴加入过量的氢氧化钠溶液,首先发生酸碱中和反应:H++OH-=H2O,开始滴加无沉淀产生,后发生反应:Al3++3OH-=Al(OH)3↓;Fe3++3OH-=Fe(OH)3↓;当Al3+、Fe3+恰好反应完全时,沉淀达到最大值,后再加入NaOH溶液,发生反应:Al(OH)3+OH-=AlO2-+2H2O,由于Fe(OH)3不能被NaOH溶液溶解,当Al(OH)3恰好反应完全后,沉淀的量不再发生变化,故合理的图象是C;
(5)向NaAlO2溶液中通入过量CO2气体,发生AlO2-+CO2+H2O=Al(OH)3↓+HCO3-,过滤得到滤渣中含有Al(OH)3,得到的滤液③中含有HCO3-,向该溶液中加入NaOH溶液,发生反应: HCO3-+OH-=CO32-+H2O;
(6)滤渣是Al(OH)3,将其灼烧,发生分解反应:2Al(OH)3![]() Al2O3+H2O,最后得到氧化铝。
Al2O3+H2O,最后得到氧化铝。