题目内容
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2Cr2O4。考虑到胶体的吸附作用使Na2Cr2O4不易完全被水浸出,某研究小组利用设计的电解分离装置(如图1),使浆液分离成固体混合物和含铬元素溶液,并回收利用。

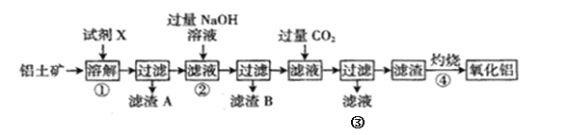
固体混合物的分离和利用的流程图如图2所示(流程图中的部分分离操作和反应条件未标明):

(1)反应①所加试剂NaOH的电子式为___,B→C的反应条件为___,C→Al的制备方法称为___。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有___(填序号)。
a.温度 b.Cl-的浓度 c.溶液的酸度
【答案】![]() 加热(或煅烧) 电解法 ac
加热(或煅烧) 电解法 ac
【解析】
在图1中,与电源负极相连的是电解池的阴极,发生反应为2H2O+2e-=2OH-+H2↑,混合物浆液中Na+向阴极移动;与电源正极相连的是电解池的阳极,发生反应为2H2O-4e-=O2↑+4H+,混合物浆液中的Cr2O42-向阳极移动。此时混合物浆液中的物质为Al(OH)3、MnO2。在图2中,固体混合物中加入NaOH溶液,Al(OH)3溶解生成NaAlO2溶液,此为溶液A的主要成分,MnO2为固体D的主要成分。溶液A中通入CO2,与NaAlO2发生反应:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,沉淀B的主要成分为Al(OH)3,受热分解生成Al2O3,成为固体C的主要成分,熔融电解可获得Al。固体D中的MnO2与浓盐酸在加热条件下反应,可制得Cl2。
(1)NaOH为离子化合物,由Na+和OH-构成,电子式为![]() 。根据图2中的转化关系,向溶液A中通入CO2,发生反应:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,沉淀B为Al(OH)3,固体C为Al2O3,B→C的反应条件为加热或煅烧,Al2O3→Al的制备方法为氧化铝的熔融电解法。答案为:
。根据图2中的转化关系,向溶液A中通入CO2,发生反应:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,沉淀B为Al(OH)3,固体C为Al2O3,B→C的反应条件为加热或煅烧,Al2O3→Al的制备方法为氧化铝的熔融电解法。答案为:![]() ;加热或煅烧;电解法;
;加热或煅烧;电解法;
(2)根据“D与浓盐酸混合,不加热,无变化;加热有Cl2生成”知,温度对反应有影响;滴加硫酸,引入H+,又产生Cl2,说明溶液的酸度对反应有影响。答案为:ac。

【题目】T K时,向2.0 L恒容密闭容器中充入0.10 mol COCl2,发生反应COCl2(g)![]() Cl2(g)+CO(g),经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
下列说法正确的是( )
A. 保持其他条件不变,升高温度,平衡时c(Cl2)=0.038 mol·L-1,则反应的ΔH<0
B. 反应在前2 s的平均速率v(CO)=0.015 mol·L-1·s-1
C. 保持其他条件不变,起始时向容器中充入0.12 mol COCl2、0.06 mol Cl2和0.06 mol CO,反应达到平衡前的速率:v正<v逆
D. 保持其他条件不变,起始时向容器中充入0.10 mol Cl2和0.08 mol CO,达到平衡时,Cl2的转化率大于60%