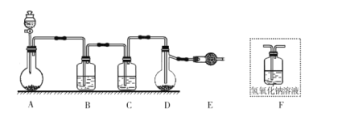
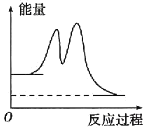
题目内容
【题目】硼及其化合物广泛应用于能源、材料等领域。
(1)钕铁硼是磁性材料,被称为“磁王”。钕的价电子排布式为4f46s2,则钕原子的未成对电子数有__个。
(2)氟化硼(BF3)是石油化工的重要催化剂。BF3BF3是__分子(填“极性”或“非极性”),BF3中B—F比BF4-中B—F的键长短,原因是__。
(3)乙硼烷(B2H6)是用作火箭和导弹的高能燃料,氨硼烷(H3NBH3)是最具潜力的储氢材料之一。
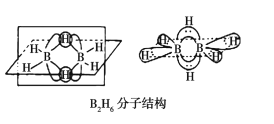
①B2H6的分子结构如图所示,其中B原子的杂化方式为__。
②H3NBH3的相对分子质量与B2H6相差不大,但是H3NBH3的沸点却比B2H6高得多,原因是__。
③同一周期中,第一电离能介于B、N之间的元素有__种。
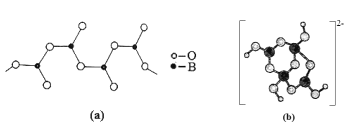
(4)硼酸盐是重要的防火材料。图(a)是一种无限链式结构的硼酸根,则该硼酸根离子符号是__,图(b)是硼酸钠晶体中阴离子(含B、O、H三种元素)的结构,该晶体中含有的化学键有__。
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键
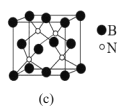
(5)立方氮化硼(BN)是超硬、耐磨、耐高温的新型材料。其晶体结构与金刚石相似,如图c所示,则B的配位数为__,测得B与N的原子核间距为anm,晶体的密度为dg·cm-3,则阿伏加德罗常数NA=__(列计算式即可)。
【答案】4 非极性 BF3中B采用sp2杂化,BF4-中B采用sp3杂化,s轨道成分越多,电子云重叠程度越大,键长越短[或BF3中除了σ键,还有(π![]() )大π键] sp3杂化 H3NBH3分子间存在(双)氢键,分子间作用力更大 3 [BO2]
)大π键] sp3杂化 H3NBH3分子间存在(双)氢键,分子间作用力更大 3 [BO2]![]() 或BO2- ABD 4
或BO2- ABD 4 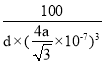 或
或![]()
【解析】
F能级有7个轨道,BF3中B的价电子对数为![]() ;乙硼烷分子中每个硼原子含有4个共价键;氢键使分子间作用力更大;根据(4)图可知,一个B原子与3个O原子连接,但有2个O原子是与其他B原子共用的;根据晶胞结构可知,B原子位于晶胞的顶点和面心,N原子为体内。
;乙硼烷分子中每个硼原子含有4个共价键;氢键使分子间作用力更大;根据(4)图可知,一个B原子与3个O原子连接,但有2个O原子是与其他B原子共用的;根据晶胞结构可知,B原子位于晶胞的顶点和面心,N原子为体内。
(1)f能级有7个轨道,根据钕的价电子排布式为4f46s2,4个电子分别占在4个不同的轨道,自旋相同,则钕原子的未成对电子数有4个。
(2)因BF3中B的价电子对数为![]() ,B采取sp2杂化,则BF3空间构型为平面三角形,是对称结构,故BF3是非极性分子;BF3中未杂化的2pz轨道与F的2pz轨道平行重叠形成大π键,故BF3中B—F比BF4-中B—F的键长短。
,B采取sp2杂化,则BF3空间构型为平面三角形,是对称结构,故BF3是非极性分子;BF3中未杂化的2pz轨道与F的2pz轨道平行重叠形成大π键,故BF3中B—F比BF4-中B—F的键长短。
(3)①乙硼烷分子中每个硼原子含有4个共价键,所以B原子采用sp3杂化;
②H3NBH3中与N连接的H显正电性,与B连接的H显负电性,形成双氢键,分子间作用力更大,故H3NBH3的沸点却比B2H6高得多。
③同一周期中,第一电离能介于B、N之间的元素有Be、C、O,共3种。
(4)一个B原子与3个O原子连接,但有2个O原子是与其他B原子共用的,故硼酸根离子符号是[BO2]![]() 或BO2-;根据图(b)可知,硼酸钠晶体中钠离子与硼酸根离子间为离子键硼原子与氧原子形成极性键,同时存在配位键。
或BO2-;根据图(b)可知,硼酸钠晶体中钠离子与硼酸根离子间为离子键硼原子与氧原子形成极性键,同时存在配位键。
(5)晶立方氮化硼体结构与金刚石相似,N形成4个共价键,则B的配位数为4;根据均摊法可计算出晶胞中硼原子数为![]() ,N原子数为4,则晶胞的质量为
,N原子数为4,则晶胞的质量为![]() ,将晶胞分割成8个小立方体,则体对角线为2anm,得出该晶体的体对角线为4anm,设晶胞参数为xnm,则有4a=
,将晶胞分割成8个小立方体,则体对角线为2anm,得出该晶体的体对角线为4anm,设晶胞参数为xnm,则有4a=![]() x,x=
x,x=![]() , 根据
, 根据![]() ,得d=
,得d=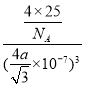 ,则NA=
,则NA=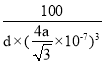 。
。

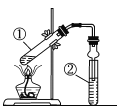
【题目】利用下图实验装置进行有关实验,下列对结论的叙述正确的是
选项 | ①中试剂 | ②中试剂 | 结论 |
|
A | 镁条、蒸馏水 | 肥皂水 | ②中开始出现气泡,说明①中生成了氢气 | |
B | 铜片、硝酸溶液 | 蒸馏水 | ②中试管口出现红棕色气体,说明①中生成了NO2 | |
C | 二氧化锰、浓盐酸 | 淀粉KI溶液 | 该装置可以用来检验①中是否产生了氯气 | |
D | 乙醇、乙酸、浓硫酸 | 饱和NaOH溶液 | 该装置可以用来制备乙酸乙酯 |
A. A B. B C. C D. D