题目内容
某元素的单质0.2mol与足量的水反应,可生成标准状况下的氢气2.24L.反应生成的该元素离子有10个电子,该元素是( )
| A、K | B、Cl | C、Na | D、S |
考点:化学方程式的有关计算
专题:计算题
分析:某元素的单质与足量的水反应置换出氢气,单质供电子,根据氧化还原反应电子转移守恒,计算单质失去的电子数.结合单质失去形成具有Ne原子的电子层结构的离子,确定单质元素的质子数,进而确定单质元素.
解答:
解:氢气的物质的量为
=0.1mol;
令单质原子失去的电子数为n,根据电子转移守恒有:
0.2mol×n=0.1mol×2,解得n=1,
金属原子失去1个电子形成的金属离子具有Ne原子的电子层结构的离子,
所以+1价金属离子核外有10个电子,故该金属元素质子数为10+1=11,
即该金属为Na元素,
故选C.
| 2.24L |
| 22.4L/mol |
令单质原子失去的电子数为n,根据电子转移守恒有:
0.2mol×n=0.1mol×2,解得n=1,
金属原子失去1个电子形成的金属离子具有Ne原子的电子层结构的离子,
所以+1价金属离子核外有10个电子,故该金属元素质子数为10+1=11,
即该金属为Na元素,
故选C.
点评:本题考查通过计算推断元素,难度中等,注意从氧化剂、还原剂得失电子的数目关系判断金属元素原子失去电子数目是解题的关键.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
下列离子方程式书写正确的是( )
| A、在100mL浓度为1mol?L-1的Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ |
| B、在100mL浓度为2mol?L-1的FeI2的溶液中通入标准状况下5.6L的Cl2:4Fe2++6I-+5Cl2═4Fe3++3I2+10Cl- |
| C、向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
| D、向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
设NA表示阿伏加德罗常数值,下列叙述中正确的是( )
| A、电解食盐水若产生2g氢气,则转移的电子数目为NA |
| B、电解精炼铜时转移0.1NA个电子,则阳极溶解3.2g铜 |
| C、100mL 1mol/L的醋酸溶液中,CH3COO-离子数为0.1NA |
| D、VL a mol/L FeCl3溶液中,若Fe3+数目为NA,则Cl-的数目大于3NA |
Se是人体必需微量元素,下列有关
Se和
Se的说法正确的是( )
78 34 |
80 34 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
某地有甲、乙两工厂排放污水,污水中各含有下列8种离子中的4种(两厂不含相同的离子):Ag+、Ba2+、Fe3+、Na+、SO42-、NO3-、OH-、Cl-.两厂单独排放都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便变成无色澄清的只含硝酸钠而排放,污染程度大大降低.关于污染源的分析,你认为正确的是( )
| A、SO42-和NO3- 可能来自同一工厂 |
| B、Cl-和NO3- 一定在不同的工厂 |
| C、Ag+和Na+可能来自同一工厂 |
| D、Na+和NO3- 一定不来自同一工厂 |
一包白色粉末,由几种常见的盐混合组成,其中可能含有Na+、K+、Al3+、CO32-、HCO3-、SO42-、SO32-、NO2-中的若干种离子.某同学对该溶液进行如下实验:
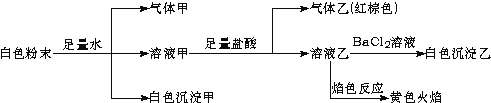
以下说法正确的是( )

以下说法正确的是( )
| A、白色沉淀甲是Al(OH)3,气体甲是CO2,所以混合物一定含Al3+和HCO3- |
| B、气体乙一定是NO和NO2的混合气体 |
| C、白色沉淀乙是BaSO4,所以原混合物一定含有SO42- |
| D、焰色反应为黄色火焰,不能确定原混合物中不含K+ |
如图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数.
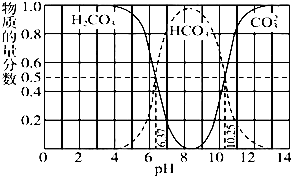
下列叙述正确的是( )

下列叙述正确的是( )
| A、此图是1.0mol?L-1碳酸钠溶液滴定1.0 mol?L-1?HCl溶液的滴定曲线 |
| B、在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-) |
| C、人体血液的pH约为7.4,则CO2在血液中多以HCO-3形式存在 |
| D、若用CO2和NaOH反应制取NaHCO3,应控制溶液的pH偏大或偏小 |
下列说法中,正确的是( )
| A、对“地沟油”进行分馏可以获得汽油发动机的燃料 |
| B、乙烯和聚乙烯都可与溴水发生加成反应 |
| C、研究表明禽流感病毒H7N9在沸水中两分钟就能被杀死,是因为蛋白质受热易变性 |
| D、乙醇和乙酸的反应与苯和液溴的反应类型不同 |
