题目内容
【题目】H2、CO、CO2和CH4都是中学化学常见的气体。某无色气体X可能含有上述4种气体中的一种或两种。为了确认气体X的组成,同学们按下图装置进行实验。(气体燃烧装置中能提供足量的氧气保证可燃性气体充分燃烧,甲烷燃烧的产物为CO2和H2O)
小资料:碱石灰的主要成分是CaO和NaOH,能吸收CO2和水蒸气。
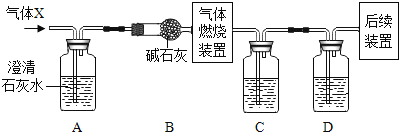
(1)装置A的作用是_________,装置B的作用是______。
(2)装置C盛放的试剂是_____(填序号),D中盛放的试剂是_____(填序号)。
a.烧碱溶液 b.浓硫酸
(3)若取1.6g气体X进行实验(假设每步反应都完全),发现装置A中无明显变化,装置C增重1.8 g,装置D增重2.2 g。通过计算回答:
①燃烧生成CO2______mol,H2O________mol;
②说明1.6g气体X中含有碳元素________g,含有氢元素_______g。是否含有氧元素?______(填“是”或“否”)。
【答案】检验气体中是否含有CO2 除去CO2、H2O b a 0.05 0.1 0.6 0.2 是
【解析】
(1)根据CO2能使澄清的石灰水变浑浊,根据碱石灰的主要成分是CaO和NaOH,据此分析装置B的作用即可;
(2)先经过NaOH溶液时会带水蒸气到浓硫酸中,影响测定结果,据此进行分析判断;
(3)装置A中无明显变化,排除了CO2;装置C增重1.8 g,生成了1.8g水;装置D增重2.2 g,生成了2.2g二氧化碳;据此可以计算出所含氢元素、碳元素的质量,进而可以确定气体X的组成,然后逐一解答。
(1)CO2能使澄清的石灰水变浑浊,所以装置A的作用是检验气体中是否含有CO2;装置B中药品是碱石灰,碱石灰的主要成分是CaO和NaOH,可作干燥剂,能吸收气体中的水分和二氧化碳,
故答案为:检验气体中是否含有CO2;吸收气体中的水分和二氧化碳;
(2)装置C盛放的试剂应为浓硫酸,目的是通过是否增重测定H元素的有无,装置D中盛放的试剂是烧碱溶液,目的是通过是否增重测定C元素的有无。先经过烧碱溶液时会带出水蒸气到浓硫酸中,影响水的测定结果,所以装置C盛放的试剂是浓硫酸,D中盛放的试剂是烧碱溶液,
故答案为:b;a;
(3)装置A中无明显变化,气体中不含CO2;装置C增重1.8g,即水的物质的量是0.1mol,含H元素的质量为0.2g;装置D增重2.2g,二氧化碳的物质的量是0.05mol,可知含C元素0.6g;1.6g气体X中含H元素0.2g、含C元素0.6g,应含O元素0.8g,很明显,1.6g气体X中含有CO,且质量为1.4g,物质的量为0.05mol,刚好为C、O元素质量之和,由此可知没有CH4,气体X中还含有0.2gH2,
故答案为:0.05;0.1;0.6;0.2;是。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案