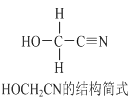
题目内容
【题目】I.用序号按要求回答下列问题:
(1)下列各种物质:①H2O②NH3③KOH④Na2O2⑤MgCl2⑥Ne,不存在化学键的是________;只存在离子键的是________;含有非极性键的离子化合物的是________。
(2)下列变化过程:①碘的升华②NaCl固体溶于水③O2溶于水④HCl气体溶于水⑤烧碱熔化⑥氯化铵受热分解,化学键没有被破坏的是________;仅破坏离子键的是________;仅破坏共价键的是________,既破坏离子键,又破坏共价键的是________。
(3)Na2O2的电子式为________________________,用电子式表示H2O的形成过程:________________________________________________。
Ⅱ.有A、B、C、D、E五种微粒。已知:
①当A微粒失去3个电子后,其电子层结构与氖原子相同;
②当B微粒得到1个电子后,其电子层结构与氩原子相同;
③C微粒带两个单位正电荷,核电荷数为12;
④D微粒有18个电子,当失去2个电子后显电中性;
⑤E微粒不带电,原子核中只有一个质子。请回答:
(1)写出这五种微粒的符号:
A______,B______,C______,D______,E______。
(2)B微粒的结构示意图为____________,C微粒的结构示意图为____________。
(3)A的单质与EB溶液反应的离子方程式为______________________________________。
【答案】⑥ ⑤ ④ ①③ ②⑤ ④ ⑥ ![]()
![]() Al Cl Mg2+ S2- H
Al Cl Mg2+ S2- H ![]()
![]() 2Al+6H+===2Al3++3H2↑
2Al+6H+===2Al3++3H2↑
【解析】
I.①H2O为只含共价键的共价化合物;②NH3为只含共价键的共价化合物;③KOH为既含离子键又含共价键的离子化合物;④Na2O2中既含钠离子和过氧根之间的离子键,又有氧原子之间的非极性共价键;⑤MgCl2为只含离子键的离子化合物;⑥Ne为不含化学键的稀有气体单质;
(2)①碘的升华为物理变化,只破坏分子间作用力;②NaCl固体溶于水发生电离破坏离子键;③O2溶于水只破坏分子间作用力④HCl气体溶于水发生电离破坏共价键⑤烧碱为离子晶体,熔化破坏离子键;⑥氯化铵受热分解生成氨气和HCl,所以氯离子和铵根之间的离子键被破坏,铵根内部的共价键被破坏;
Ⅱ. ①当A微粒失去3个电子后,其电子层结构与氖原子相同则A为Al;
②当B微粒得到1个电子后,其电子层结构与氩原子相同,则B为Cl;
③C微粒带两个单位正电荷,核电荷数为12,则C为Mg2+;
④D微粒有18个电子,当失去2个电子后显电中性,则D为S2-;
⑤E微粒不带电,原子核中只有一个质子,则E为H。
I.(1)不存在化学键的是稀有气体,即⑥Ne;只存在离子键的是⑤MgCl2;含有非极性键的离子化合物的是④Na2O2;
(2)根据分析可知化学键没有被破坏的是①③;仅破坏离子键的是②⑤;仅破坏共价键的是④;既破坏离子键,又破坏共价键的是⑥;
(3)过氧化钠由钠离子和过氧根组成,为离子化合物,所以电子式为![]() ;H2O为共价化合物,形成过程可以表示为
;H2O为共价化合物,形成过程可以表示为![]() ;
;
Ⅱ.(1)五种微粒分别为:Al、Cl、Mg2+、S2-、H;
(2)氯原子结构示意图为![]() ;Mg2+结构示意图为
;Mg2+结构示意图为![]() ;
;
(3)Al可以和HCl反应生成氯化铝和氢气,离子方程式为:2Al+6H+===2Al3++3H2↑。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案【题目】在标准状况下进行甲、乙、丙三组实验:三组各取30.0 mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 255 | 385 | 459 |
产生气体体积/mL | 280 | 336 | 336 |
请回答:
(1)甲组实验中,盐酸______________(选填“适量”“过量”或“不足量”,下同),理由是______________。要算出盐酸的物质的量浓度,题中可作计算依据的数据是______________。求得的盐酸的物质的量浓度为______________。
(2)求合金中Mg、Al的物质的量之比,题中可作计算依据的数据是______________,求得的Mg、Al的物质的量之比为______________;
(3)在丙组实验之后,向容器中加入1.00 mol·L-1 NaOH溶液,能使合金中的铝恰好溶解,不形成铝的沉淀,并使Mg2+刚好沉淀完全,再过滤出不溶性固体,求滤液中各溶质的物质的量和所加入NaOH溶液的体积(写计算过程)。___________________
【题目】J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表。J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
J | ||||
R |
(1)M的离子结构示意图为__________;元素T在周期表中位于第________族。
(2)J元素名称是______,他和氢组成10电子的化合物,其分子式为______________,属___________(填“离子化合物”或“共价化合物”)。
(3)R元素符号为_______,其最高能层符号是________。