题目内容
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
Ⅰ.利用反应:6NO2+8NH3![]() 7N2+12H2O处理
7N2+12H2O处理
Ⅱ.一定条件下NO2与SO2可发生反应:NO2(g)+SO2(g)![]() SO3(g)+NO(g)-Q (Q>0)
SO3(g)+NO(g)-Q (Q>0)
Ⅲ.CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
(1)硫离子最外层电子的电子排布式为_____,氨气分子的电子式为______,氨气分子属于______分子(填“极性”或者“非极性”)。
(2)C、O、S这三种元素中属于同周期元素的非金属性由强到弱的顺序为______,能证明其递变规律的事实是_______。
a.最高价氧化物对应水化物的酸性 b.气态氢化物的沸点
c.单质与氢气反应的难易程度 d.其两两组合形成的化合物中元素的化合价
(3)对于Ⅰ中的反应,120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均速率v(NO2)=_______。
(4)对于Ⅱ中的反应,将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是______。
a.体系压强保持不变 b.NO2浓度保持不变
c.NO2和SO3的体积比保持不变 d.混合气体的平均相对分子质量保持不变
(5)请写出Ⅱ中反应的平衡常数表达式K=_______,如果Ⅱ中反应的平衡常数K值变大,该反应______。
a.一定向正反应方向移动 b.平衡移动时,正反应速率先减小后增大
c.一定向逆反应方向移动 d.平衡移动时,逆反应速率先增大后减小
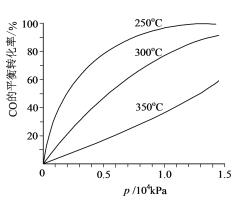
(6)对于Ⅲ中的反应,CO在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在250℃、1.3×104kPa左右,简述选择此压强的理由:______。
【答案】3s23p6 ![]() 极性 O>C d 0.015mol/(L·min) bc
极性 O>C d 0.015mol/(L·min) bc ![]() a 在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失。
a 在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失。
【解析】
(1)S2-的核外电子总数为18,最外层为M层,含有8个电子;氨气为共价化合物,分子中含有3个N-H键,属于极性分子;
(2)同一周期的元素,随原子序数增大元素的非金属性增强;
a.氧元素没有含氧酸;
b.物理性质不能比较非金属性强弱;
d.单质的结构不同,不能说明元素的非金属性;
d.化合物中表现负价的元素,对键合电子的吸引力更强,非金属性更强;
(3)利用氧化还原反应中电子转移计算出参加反应的NO2,然后再根据速率公式进行计算;
(4)当可逆反应达到平衡状态时,任何一组分的物质的量、浓度及含量等保持不变;
(5)平衡常数等于平衡时生成物的浓度幂之积比上反应物浓度幂之积;反应的平衡常数K值变大,只有改变温度使得平衡正向移动;
(6)由图示可知:相同压强下,温度升高,该反应CO的平衡转化率降低,说明平衡逆向移动,则正反应为放热反应;根据此时CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失。
(1)S是16号元素,S2-最外层达到8电子稳定结构,其核外电子排布为1s22s22p63s23p6,则其最外层电子排布式3s23p6;
NH3为共价化合物,分子中含有3个N-H键,其电子式为![]() ,N-H为极性键,且氨气分子为V型结构,则氨气属于极性分子;
,N-H为极性键,且氨气分子为V型结构,则氨气属于极性分子;
(2)C、O、S三种元素中,属于同一周期的元素是C、O,同一周期的元素,原子序数越大,吸引电子能力就越强,元素的非金属性增强,故元素的非金属性O>C。
a.O元素没有含氧酸,不能利用最高价比较O元素与C元素的非金属性,a错误;
b.H2O分子之间存在氢键,增加了分子之间的作用力,而CH4分子之间无氢键,不能通过比较氢化物的沸点判断元素非金属性强弱,B错误;
c.单质与H2反应的难易程度,说明单质的氧化性强弱,单质的结构不同,不能说明元素的非金属性,C错误;
d.C、O两种元素形成的是共价化合物,元素的化合价,说明共用电子对偏移方向,化合物中表现负价的元素,对键合电子的吸引力更强,非金属性更强,D正确;
故合理选项是D;
(3)对于6NO2+8NH3![]() 7N2+12H2O,当有6molNO2反应共转移了24mol电子,所以电子转移了1.2mol,说明参加反应的NO2的物质的量是0.3mol,则在0~10min时,平均反应速率υ(NO2)=
7N2+12H2O,当有6molNO2反应共转移了24mol电子,所以电子转移了1.2mol,说明参加反应的NO2的物质的量是0.3mol,则在0~10min时,平均反应速率υ(NO2)=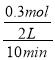 =0.015mol/(Lmin);
=0.015mol/(Lmin);
(4)a.无论反应是否达到平衡状态,反应体系内的压强始终不变,故不能根据“体系压强保持不变”判断反应是否达到平衡状态,a错误;
b.当反应达到平衡状态时,NO2的浓度不变,所以能根据“混合气体颜色保持不变”判断反应是否达到平衡状态,b正确;
c.随反应进行NO2和SO3的体积之比会发生变化。若NO2和SO3的体积之比保持不变,说明反应到达了平衡状态,c正确;
d.反应前后气体的质量不变,物质的量也不变,所以平均相对分子质量始终保持不变,因此不能根据“混合气体的平均相对分子质量保持不变”判断反应是否达到平衡状态,d错误;
故合理选项是bc;
(5)根据平衡常数的含义可知反应NO2(g)+SO2(g)![]() SO3(g)+NO(g) -Q(Q>0)的平衡常数K=
SO3(g)+NO(g) -Q(Q>0)的平衡常数K=![]() ;
;
化学平衡常数只与温度有关,该反应的正反应为吸热反应,如果该反应平衡常数K值变大,说明平衡正向移动,温度升高,正反应速率先突然增大后又有所减小,逆反应速率先增大再增大,故合理选项是a;
(6)由图示可知,在250℃、1.3×104kPa左右时CO的转化率已经很高,如果增加压强CO的转化率提高不大,反而使生产成本增加,得不偿失。

【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,按要求用化学式或化学用语填空,用序号填写不得分。
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | |||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为_____________;
(2)地壳中含量最多的非金属元素是_____________;
(3)与水反应最剧烈的金属单质是_____________;
(4)某元素三价阳离子的核外有10个电子,该元素是_____________;
(5)气态氢化物最稳定的化合物是_____________;
(6)①的最高价氧化物的电子式为_____________;
(7)用电子式表示④和⑨形成化合物的过程_____________。
(8)最高价氧化物对应的水化物碱性最强的化合物是_____________;元素的最高价氧化物对应的水化物中具有两性的化合物是_____________;两者反应的离子方程式为_____________。