题目内容
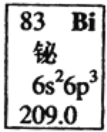
【题目】科学家曾合成具有独特结构的化合物1和2,发现化合物1加热后可得化合物2。以下关于化合物1和2的说法中正确的是( )
A. 化合物1和2互为同分异构体
B. 化合物1中所有原子处于同一平面
C. 化合物1和2均属于芳香族化合物
D. 1 mol化合物2完全燃烧消耗O213.5 mol (Br燃烧生成![]() HBr)
HBr)
【答案】A
【解析】
A.由图可知,两种化合物的分子式均为C12H6Br6,但结构不同,则二者互为同分异构体,故A正确;
B.化合物1中存在-CHBr-结构,为四面体结构,所以化合物1中所有原子不可能处于同一平面,故B错误;
C.化合物2中不含有苯环,则化合物2不属于芳香族化合物,故C错误;
D.化合物2的分子式为C12H6Br6,Br![]() HBr,化合物2燃烧的方程式为C12H6Br6+12O2
HBr,化合物2燃烧的方程式为C12H6Br6+12O2![]() 12CO2+6HBr,1mol化合物2完全燃烧消耗O212mol,故D错误;
12CO2+6HBr,1mol化合物2完全燃烧消耗O212mol,故D错误;
答案选A。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】在标准状况下进行甲、乙、丙三组实验:三组各取30.0 mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 255 | 385 | 459 |
产生气体体积/mL | 280 | 336 | 336 |
请回答:
(1)甲组实验中,盐酸______________(选填“适量”“过量”或“不足量”,下同),理由是______________。要算出盐酸的物质的量浓度,题中可作计算依据的数据是______________。求得的盐酸的物质的量浓度为______________。
(2)求合金中Mg、Al的物质的量之比,题中可作计算依据的数据是______________,求得的Mg、Al的物质的量之比为______________;
(3)在丙组实验之后,向容器中加入1.00 mol·L-1 NaOH溶液,能使合金中的铝恰好溶解,不形成铝的沉淀,并使Mg2+刚好沉淀完全,再过滤出不溶性固体,求滤液中各溶质的物质的量和所加入NaOH溶液的体积(写计算过程)。___________________
【题目】仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置就能实现相应实验目的的是( )
选项 | A | B | C | D |
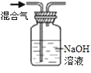
实验目的 | 除去KCl中少量的MnO2 | 用10mol·L-1的盐酸配制100mL0.1 mol·L-1的盐酸 | 用氯化钠溶液制备氯化钠晶体 | 除去CO2气体中的HCl |
实验仪器或装置 | 烧杯、玻璃棒、分液漏斗 | 100mL容量瓶、玻璃棒、烧杯 |
|
|
A.AB.BC.CD.D