题目内容
13.ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂.已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与纯净的氯气反应 2NaClO2+Cl2═2ClO2+2NaCl如图1是实验室用于制备和收集一定量纯净的ClO2的装置(某些夹持装置和垫持用品省略).其中E中盛有CCl4液体.
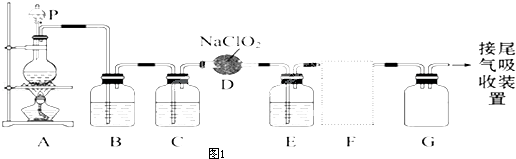
(1)仪器P的名称是分液漏斗
(2)写出装置A中烧瓶内发生反应的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(3)E装置中所盛试剂的作用是用于除去ClO2中未反应的Cl2
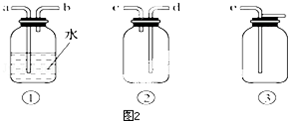
(4)F处应选用的收集装置是图2②(填序号),其中与E装置导管相连的导管口是图2d(填接口字母).
(5)以下是尾气吸收装置,能用于吸收多余ClO2气体,并能防止倒吸的装置的是如图3的D
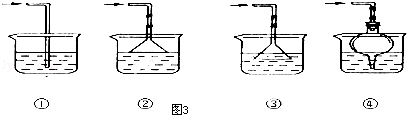
A.①②B.②③C.③④D.②④
(6)若用100mL 2mol•L-1的浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量是C(填序号).
A.>0.1mol B.0.1mol C.<0.1mol D.无法判断.
(7)ClO2也可由NaClO3在H2SO4溶液存在下与Na2SO3反应制得.请写出反应的化学方程式:2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O.
分析 由题目中所给信息和实验装置图可知:本实验首先用浓盐酸和MnO2在加热条件下反应制备Cl2,反应的方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,经除杂、干燥后在D中亚氯酸钠固体反应生成ClO2,由于Cl2易溶于CCl4液体,E用于除去ClO2中的未反应的Cl2,最后用向上排空法收集;并注意气体的性质和装置来分析防止倒吸的装置,利用稀盐酸与二氧化锰不反应来分析浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量.
(1)实验室用浓盐酸和MnO2在加热条件下反应制备Cl2,浓盐酸应盛装在分液漏斗中,则P为分液漏斗;
(2)浓盐酸和MnO2在加热条件下反应制备Cl2;
(3)生成的ClO2中混有氯气,为制备纯净干燥的ClO2,根据氯气易溶于四氯化碳,使用四氯化碳来除去氯气;
(4)ClO2是一种易溶于水的气体,且密度比空气大,应用向上排空气法收集,且进行尾气处理,故用双孔橡皮塞;
(5)ClO2是一种易溶于水的气体,尾气吸收时要防止倒吸,导气管不能插入到液面以下;
(6)浓盐酸在加热条件下与二氧化锰发生氧化还原反应,但随着反应的进行,盐酸浓度变稀时,不与二氧化锰反应;
(7)由KClO3在H2SO4存在下与Na2SO3反应制得二氧化氯,还生成硫酸钾、水.
解答 解:(1)实验室用浓盐酸和MnO2在加热条件下反应制备Cl2,浓盐酸应盛装在分液漏斗中,则P为分液漏斗,故答案为:分液漏斗;
(2)浓盐酸和MnO2在加热条件下反应制备Cl2,反应的方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)ClO2是一种易溶于水而难溶于有机溶剂的气体,生成的ClO2中混有氯气,氯气易溶于四氯化碳,为制备纯净干燥的ClO2,使用四氯化碳来除去氯气,
故答案为:用于除去ClO2中未反应的Cl2;
(4)ClO2是一种易溶于水的气体,且密度比空气大,应用向上排空气法收集,且进行尾气处理,故用双孔橡皮塞,
故答案为:②;d;
(5)ClO2是一种易溶于水的气体,尾气吸收时要防止倒吸,导气管不能插入到液面以下,②④符合,
故答案为:D;
(6)浓盐酸在加热条件下与二氧化锰发生氧化还原反应,但随着反应的进行,盐酸浓度变稀时,不与二氧化锰反应,根据MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知,若用100mL 2mol•L-1的浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量<0.1mol,
故答案为:C;
(7)KClO3在H2SO4存在下与Na2SO3反应,SO32-被氧化成SO42-,由电子、电荷守恒可知该离子反应为2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O,
故答案为:2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O.
点评 本题考查了氯气的制取、氯气的性质、氯气的尾气处理等知识点,题目难度中等,学习中注意把握化学实验基本操作,做该类题目时把握实验目的和实验原理是解答题目的关键.

| A. | Be(OH)2可能具有两性 | |
| B. | 氯化铍中铍原子的最外层电子数是8个 | |
| C. | 氢氧化铍的碱性比氢氧化钙强 | |
| D. | 单质铍可和冷水剧烈反应产生氢气 |
| A. | CH4与C2H4 | B. | C2H6与C3H8 | ||
| C. | 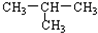 与CH3-CH2-CH2-CH3 与CH3-CH2-CH2-CH3 | D. | O2与O3 |
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A. | ①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小 | |
| B. | 分别加水稀释10倍,四种溶液的pH:①>②>④>③ | |
| C. | 溶液中水的电离程度③>④ | |
| D. | VaL④溶液与VbL②溶液混合后,若混合后溶液pH=4,则Va:Vb=11:9 |
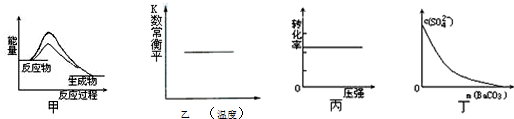
| A. | 图甲表示使用催化剂后,该反应的△H变小 | |
| B. | 图乙表示反应NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g)△H=-373.4kJ•mol-1反应的平衡常数随温度的变化 | |
| C. | 图丙表示反应H2(g)+I2(g)?2HI(g)中H2的转化率随压强的变化 | |
| D. | 图丁表示在饱和Na2SO4溶液中逐步加BaCO3固体后,溶液中c(${SO}_{4}^{2-}$)的浓度变化 |
| A. | 实验室制备硝基苯加入试剂的顺序为:先加入浓硫酸,再滴加苯,最后滴加浓硝酸 | |
| B. | 蔗糖和葡萄糖不是同分异构体,但属同系物 | |
| C. | 可用金属钠区分乙酸、乙醇和苯 | |
| D. | 石油裂解和煤的干馏都是化学变化,而石油的分馏和煤的气化都是物理变化 |
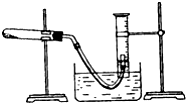 某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量.实验步骤如下:
某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量.实验步骤如下: