题目内容
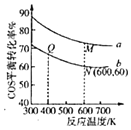
【题目】如图中C%表示某反应物在体系中的百分含量,v表示反应速率,p表示压强,t表示反应时间。图(A)为温度一定时,压强与反应速率的关系曲线;图(B)为压强一定时,在不同时间C%与温度的关系曲线。同时符合以下两个图像的反应是( )
A 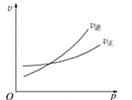 B
B 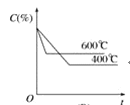
A.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
B.N2O3(g)![]() NO2(g)+NO(g) ΔH>0
NO2(g)+NO(g) ΔH>0
C.3NO2(g)+H2O(l)![]() 2HNO3(l)+NO(g) ΔH<0
2HNO3(l)+NO(g) ΔH<0
D.CO2(g)+C(s)![]() 2CO(g) ΔH>0
2CO(g) ΔH>0
【答案】A
【解析】
由图A可知,到达平衡后,增大压强逆反应速率增大更大,平衡向逆反应移动,说明气体反应物的化学计量数之和小于气体生成物的化学计量数之和,由图B可知,温度越高平衡时反应物的百分含量越高,说明升高温度,平衡向逆反应移动,故正反应为放热反应。
由图(B)可知,温度越高,平衡时反应物的百分含量越高,平衡向逆反应移动,温度升高平衡向吸热的方向移动,逆反应吸热,正反应为放热反应,ΔH<0,故A正确;B、D项错误;
图(A)中正逆反应速率相等时达到平衡,平衡后增大压强,正逆速率都增大,但逆反应速率更大,平衡逆移,增大压强平衡向气体分子数减小的方向移动,逆反应方向应气体分子数减小,C项错误;
故选A。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用要求处理电池废料以节约资源、保护环境。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(由Al箔、LiFePO4活性材料、少量不溶于酸碱的导电剂组成)中的资源,部分流程如图:
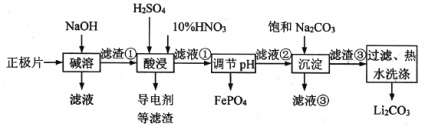
已知:Ksp(Li2CO3)=1.6×10-3。部分物质的溶解度(S)如表所示:
T/℃ | S(Li2CO3)/g | S(Li2SO4)/g | S(Li3PO4)/g | S(LiH2PO4)/g |
20 | 1.33 | 34.2 | 0.039 | 126 |
80 | 0.85 | 30.5 | —— | —— |
(1)将回收的废旧锂离子电池进行预放电、拆分破碎、热处理等预处理,筛分后获得正极片。下列分析你认为合理的是__________。
A.废旧锂离子电池在处理之前需要进行彻底放电,否则在后续处理中,残余的能量会集中释放,可能会造成安全隐患。
B.预放电时电池中的锂离子移向负极,不利于提高正极片中锂元素的回收率。
C.热处理过程可以除去废旧锂离子电池中的难溶有机物、碳粉等。
(2)写出碱溶时主要发生反应的离子方程式:________。
(3)为提高酸浸的浸出率,除粉碎、搅拌、升温外,还可采用的方法有______。(写出一种即可)
(4)酸浸时产生标况下3.36 L NO时,溶解LiFePO4________mol(其他杂质不与HNO3反应)。
(5)若滤液②中c(Li+)=4 mol·L-1,加入等体积的Na2CO3后,沉淀中的Li元素占原Li元素总量的90%,计算滤液③中c(CO32-)=__________mol/L。
(6)流程中用“热水洗涤”的原因是________。
(7)工业上将回收的Li2CO3、FePO4粉碎与足量炭黑混合高温灼烧再生制备LiFePO4,写出反应的化学方程式:_________。
【题目】合成气的主要成分是一氧化碳和氢气,可用于合成甲醇、二甲醚等清洁燃料。从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.1 kJ/mol
CO(g)+3H2(g) △H1=+206.1 kJ/mol
②CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H2=+247.3 kJ/mol
2CO(g)+2H2(g) △H2=+247.3 kJ/mol
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图所示:

则反应前5min的平均反应速率v(H2)=______。10min时,改变的外界条件可能是_______(填代号)。
A.压缩体积 B.增大体积 C.升高温度 D.加入催化剂
(2)如图所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。
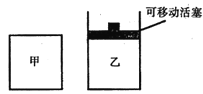
已知甲容器中CH4的转化率随时间变化的图像如图所示,请在图中画出乙容器中CH4的转化率随时间变化的图像_______。
(3)反应③中△H3=________。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时反应③中正、逆反应速率的关系式是________(填代号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(4)800K时向下列三个密闭容器中各充入2 mol H2、1 mol CO,发生反应:2H2(g)+CO(g)CH3OH(g) △H<0,若三容器初始体积相同,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。
甲. 乙.
乙. 丙.
丙.
①达到平衡时,平衡常数K(甲)________K(乙);K(乙)________K(丙)(填“>”、“<”或“=”)。
②达到平衡时H2的浓度c(H2)(甲)________c(H2)(乙);c(H2)(乙)________c(H2)(丙)(填“>”、“<”或“=”)。
(5)在以甲醇为燃料的电池中,电解质溶液为碱性,负极的电极反应式为_________,甲醇应用于燃料电池比甲醇直接用作燃料燃烧的优点是_______(回答一条即可)。