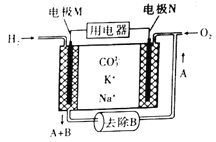
��Ŀ����
����Ŀ���±���Ԫ�����ڱ��е�һ���֣����ݢ١��������ڱ��е�λ�ã���Ԫ�ط��Ż�ѧʽ�ش��������⣺
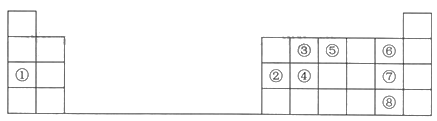
(1)Ԫ�آ���Ԫ�����ڱ��е�λ��Ϊ________��
(2)����������ˮ�����м�����ǿ�����ʵĵ���ʽΪ________��
(3)д���ں͢�����Ԫ�ص�����������ˮ�������Ӧ�Ļ�ѧ����ʽ:_______��
(4)�ܡ��ݡ�������Ԫ�ذ�ԭ�Ӱ뾶�ɴ�С��˳������Ϊ_______��
(5)�ۺ͢�����Ԫ���γɵļ�����ĽṹʽΪ_______���ռ乹��Ϊ________��
(6)���ʵ��̽���ߡ�������Ԫ�طǽ����Ե����ǿ����
��ѡ�õ��Լ���:��ˮ��NaBr��Һ��AgNO3��Һ������
�����ʵ�鱨�浥��
����һ | ����� | |
ʵ������ | �Թ�1:ȡ������ˮ�� �Թ�2:ȡ������ˮ���μ�����NaBr��Һ�� | �ֱ����Թ�1���Թ�2�м�����______(���Լ�)�������á� |
ʵ������ | �Թ�2�е�������______�� | �Թ�2�е�������_______�� |
ʵ����� | �Թ�1��������_____�� | �Թ�2�з�Ӧ�����ӷ���ʽΪ_____����ʵ��Ľ�����_____�� |
���𰸡� ��3����IVA�� ![]() Al(OH)3+3HClO4=Al(ClO4)3+3H2O Si��N��F
Al(OH)3+3HClO4=Al(ClO4)3+3H2O Si��N��F  ���������� �� ��Һ����ɫ��Ϊ�Ȼ�ɫ ��Һ�ֲ㣬�ϲ�Ⱥ�ɫ���²�ӽ���ɫ �Ա�ʵ�� Cl2+2Br-=2Cl-+Br2 Cl�ķǽ����Ա�Brǿ
���������� �� ��Һ����ɫ��Ϊ�Ȼ�ɫ ��Һ�ֲ㣬�ϲ�Ⱥ�ɫ���²�ӽ���ɫ �Ա�ʵ�� Cl2+2Br-=2Cl-+Br2 Cl�ķǽ����Ա�Brǿ
�����������⿼��Ԫ�����ڱ���Ԫ�������ɵ����֪ʶ������Ԫ�����ڱ���֪��Na ��Al ��C ��Si ��N ��F ��Cl ��Br�����Ԫ�������ɺ�Ԫ�صĻ������ʽ��������⡣
(1)Ԫ�آ�ΪSiԭ������Ϊ14����Ԫ�����ڱ��е�λ��Ϊ��3����IVA����
(2)������---����Ԫ��֪��Na�Ľ�������ǿ��������������ˮ����Ϊ�������Ƶļ���Ҳ��ǿ�������ʽΪ![]() ��
��
(3)��ΪAl����ΪCl������Ԫ�ص�����������ˮ����ֱ�ΪAl(OH)3��HClO4������֮�����Ӧ�Ļ�ѧ����ʽ: Al(OH)3+3HClO4=Al(ClO4)3+3H2O ��
(4)��ΪN����ΪF������ͬһ����Ԫ��������ԭ�������������ǿ, ԭ�Ӱ뾶���μ�С,����ԭ�Ӱ뾶��N>F ,��ΪSi���ڵ�������Ԫ�أ�ԭ�Ӱ뾶���ڵڶ�����Ԫ�أ�����ԭ�Ӱ뾶ΪSi>N>F������Ԫ�ذ�ԭ�Ӱ뾶�ɴ�С��˳������ΪSi��N��F��
(5) ��ΪC����ΪCl����Ԫ���γɵļ�����ΪCCl4�������ĵĽṹʽΪ ���ͼ���Ľṹ������ͬ�����Կռ乹��Ϊ��������ṹ���𰸣�
���ͼ���Ľṹ������ͬ�����Կռ乹��Ϊ��������ṹ���𰸣� ��������ṹ��
��������ṹ��
(6)����һ.�Թ�1ȡ������ˮ���Թ�2ȡ������ˮ���μ�����NaBr��Һ���Թ�2�г��ֳȺ�ɫ����Ӧ����ʽΪ��Cl2+2Br-=2Cl-+Br2���Թ�1�������Ǻ��Թ�2���Ա��õġ���������ֱ����Թ�1���Թ�2�м��������������á��Թ�2�е���������Һ�ֲ㣬�ϲ�Ⱥ�ɫ���²���ɫ���Թ�2�з�Ӧ�����ӷ���ʽΪCl2+2Br-=2Cl-+Br2����ʵ��Ľ�����Cl�ķǽ����Ա�Brǿ���𰸣�������Һ����ɫ��Ϊ�Ȼ�ɫ����Һ�ֲ㣬�ϲ�Ⱥ�ɫ���²�ӽ���ɫ���Ա�ʵ����Cl2+2Br-=2Cl-+Br2 Cl�ķǽ����Ա�Brǿ��

 �����ߴ���ϵ�д�
�����ߴ���ϵ�д�����Ŀ����ҵ���ø�����(��Ҫ�ɷֿɱ�ʾΪFeO��Cr2O3��������Al2O3��MgCO3��SiO2������)Ϊԭ���Ʊ��ظ���ؾ���(K2Cr2O7)���������������:
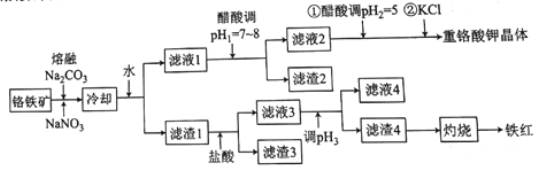
��֪:I.�������ӿ�ʼ���ɳ����ͳ�����ȫ��pH���±���ʾ:
Fe3+ | Al3+ | Mg2+ | SiO32- | AlO2- | |
��ʼ������pH | 1.9 | 4.2 | 8.1 | 9.5 | 10.2 |
������ȫ��pH | 3.2 | 5.3 | 9.4 | 8.0 | 8.5 |
II.����Na2CO3��������Ҫ������Ӧ��
2FeO��Cr2O3+4Na2CO3+7NaNO3=4Na2CrO4+Fe2O3+4CO2��+7NaNO2��
��1������Na2CO3�����»����Եõ��ĸ�����ΪNaAlO2��Na2SiO3�����������ָ�����Ļ�ѧ����ʽΪ___________________��
��2������2����Ҫ�ɷ�Ϊ________(�ѧʽ)��
��3���ô������pH2=5��Ŀ��Ϊ__________�������ڵ�pH������NO2-�ɱ�����ΪNO3-�������ӷ���ʽΪ______________��
��4������pH2����KCl����һ��������������K2Cr2O7����Ŀ���������_______��
��5������pH3�ķ�ΧΪ______��
��6��������Һ4��Fe3+�Ƿ������ȫ�ķ�����____________��
����Ŀ��ij��ѧ��ȤС��Ҫ����к��ȵIJⶨ��
��1��ʵ�����ϱ��д�С�����ձ�����ĭ���ϡ���ĭ���ϰ塢��ͷ�ιܡ���Ͳ��0.5molL��1���ᡢ0.55molL��1NaOH��Һ��ʵ����ȱ�ٵIJ�����Ʒ�� ��
��2����ʵ�����ܷ��û���ͭ˿��������滷�β��������������ܡ�������ԭ���� �� ���ڴ�С�ձ�֮����������ĭ���ϵ������� ��
��3�����Ǽ�¼��ʵ�����������
ʵ����Ʒ | ��Һ�¶� | �к��� | |||
t1 | t2 | ��H | |||
�� | 50 mL 0.55 molL��1 NaOH��Һ | 50 mL 0.5 molL��1 HCl��Һ | 20�� | 23.3�� | kJ/mol |
�� | 50 mL 0.55 molL��1 NaOH��Һ | 50 mL 0.5 molL��1 HCl��Һ | 20�� | 23.5�� | |
��֪����Ӧ����Һ�ı�����cΪ4.18kJ����1kg��1 �� �����ʵ��ܶȾ�Ϊ1gcm��3 �� ��������ϱ���������λС������
��4��ʵ����� �����ô������HCl��ʵ�飬��õ��к��ȵ���ֵ���ƫ��ƫС������Ӱ�족����
������60mL 0.5molL��1HCl��Һ��50mL 0.55molL��1NaOH��Һ���ʵ�飬������ʵ����ȣ���÷�Ӧ�ų����������ƫ��ƫС�����䡱�����к������ƫ��ƫС�����䡱��
����Ŀ����þ����Ҫ�ɷ���MgO(ռ40%)��������Na2B4O7��CaO��Al2O3��Fe2O3��FeO��MnO��SiO2�����ʡ�����þ��Ϊԭ����ȡMgSO4��7H2O�Ĺ����������£�
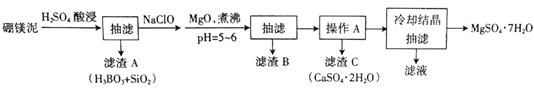
��֪���ֽ��������ӳ�����pH��Fe(OH)3��3.2��Al(OH)3��5.2��Fe(OH)2��9.7��Mg(OH)2��11.2��
(1)Ϊ������ʱ�������ʣ��ɲ�ȡ�Ĵ�ʩ��______________(д������)��
(2)H2SO4��Na2B4O7������Ӧ�Ļ�ѧ����ʽΪ________________��
(3)����NaClO���������һ�ֲ�����ˮ�ĺ�ɫ���壬��Ӧ�����ӷ���ʽΪ_________��
(4)��MgO��У���������ҺpH=5��6��Ŀ����_______________��
(5)��֪MgSO4��CaSO4���ܽ�����±���
| 10�� | 20�� | 40�� | 60�� |
MgSO4 | 28.2 | 33.7 | 44.5 | 54.6 |
CaSO4 | 0.244 | 0.255 | 0.264 | 0.265 |
������A���ǽ�MgSO4��CaSO4�����Һ�е�CaSO4����ȥ�������ϱ����ݣ�����Ϊ________________��__________________��
(6)��ʵ���ж���õ����˲�������װ����ͼ�������ͨ���ˣ����˵��ŵ���____________________��
(7)ʵ�����ṩ����þ�100g���õ�MgSO4��7H2OΪ172.2g����MgSO4��7H2O�IJ���Ϊ__________��