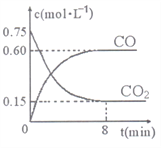
题目内容
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下。

已知:![]() +CH3Cl
+CH3Cl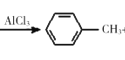 +HCl
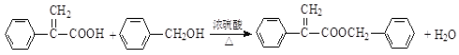
+HCl
请回答下列问题
(1)F的化学名称是__________,②的反应类型是__________。
(2)D中含有的官能团是__________(写名称),D聚合生成高分子化合物的结构简式为__________。
(3)反应③的化学方程式是____________________________________________。
(4)反应⑥的化学方程式是_______________________________________________。
(5)芳香化合物N是A的同分异构体,其中核磁共振氢谱为三组峰的结构简式为__________。
(6)参照有机物W的上述合成路线,设计以M为起始原料制备F的合成路线(无机试剂任选)。![]() __
__
【答案】苯甲醇 取代反应 羟基、羧基 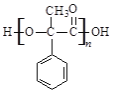
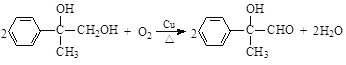
![]()
【解析】
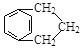
A与溴的四氯化碳溶液反应生成B,则根据B的结构简式可知A的结构简式为![]() 。B发生水解反应生成C,则C的结构简式为
。B发生水解反应生成C,则C的结构简式为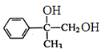 。C氧化生成D,则D的结构简式为
。C氧化生成D,则D的结构简式为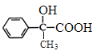 。D在浓硫酸的作用下发生消去反应生成E,则E的结构简式为
。D在浓硫酸的作用下发生消去反应生成E,则E的结构简式为![]() 。E和F发生酯化反应生成W,则W的结构简式为
。E和F发生酯化反应生成W,则W的结构简式为![]() 。
。
(1)根据F的结构简式![]() 可知F的化学名称是苯甲醇;
可知F的化学名称是苯甲醇;
反应②为B在氢氧化钠的水溶液中加热发生水解反应,也属于取代反应生成 ,反应类型是取代反应;
,反应类型是取代反应;
(2)D的结构简式为 ,含有的官能团是羟基、羧基;D聚合生成高分子化合物的结构简式为
,含有的官能团是羟基、羧基;D聚合生成高分子化合物的结构简式为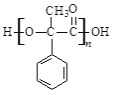 ;
;
(3)反应③是 在铜的催化下与氧气发生氧化反应生成
在铜的催化下与氧气发生氧化反应生成![]() 和水,反应的化学方程式是
和水,反应的化学方程式是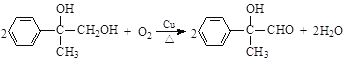 ;
;
(4)反应⑥是![]() 与
与![]() 在浓硫酸的催化下发生酯化反应生成
在浓硫酸的催化下发生酯化反应生成![]() 和水,反应的化学方程式是
和水,反应的化学方程式是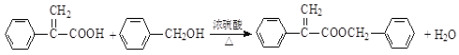 ;
;
(5)芳香化合物N是A的同分异构体,其中核磁共振氢谱为三组峰,说明含有3种不同环境的氢原子,则其结构简式为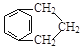 ;
;
(6)参照有机物W的上述合成路线,以M为起始原料,在氯化铝作用下反应生成甲苯,甲苯在光照条件下与氯气发生取代反应生成![]() ,
,![]() 在氢氧化钠的水溶液中加热水解生成苯甲醇,则制备F的合成路线为
在氢氧化钠的水溶液中加热水解生成苯甲醇,则制备F的合成路线为![]() 。
。

【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定,下列实验中用高锰酸钾与浓盐酸反应制备得到氯气,然后再将氯气通入氢氧化钾溶液中与氢氧化铁固体充分反应而制得产品:
(1)制备K2FeO4(夹持装置略)
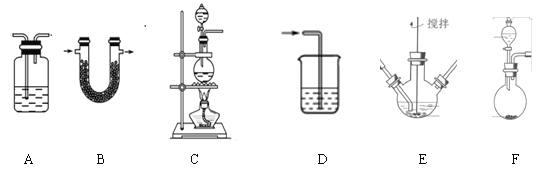
①请写出该过程中制备氯气的离子反应方程式________________(锰被还原为Mn2+)。
②请根据高铁酸钾制备的原理选择合适的装置,连接顺序为_________→ E →_________。(上述装置不一定全部用到,装置可以重复选用)
③装置E中反应时需进行搅拌,目的是_______________________
④E中得到紫色固体和溶液。E中生成高铁酸钾的反应为______________;反应充分进行后,E中溶液中主要的阴离子为__________________
(2)探究K2FeO4的性质
取E中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否是K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤E中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
①由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________产生(用方程式表示)。
②方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是______________