题目内容
【题目】硒元素(selenium)是第四周期、VIA族元素,单质有红硒、黑硒和灰硒,其中灰硒有良好的导热导电性,且有显著的光电效应,可应用于光电半导体材料。请回答下列问题:
(1)Se原子的核外电子排布式为[Ar]___________。
(2)As和Se是同一周期的元素,As的第一电离能比Se大,原因是____________。
(3)![]() 中Se―O的键角比SeO3的键角_______(填“大”或“小”),原因是____________________________________________。
中Se―O的键角比SeO3的键角_______(填“大”或“小”),原因是____________________________________________。
(4)H2Se比H2S水溶液的酸性强,原因是__________________________________。
(5)灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图和晶胞俯视图如下。
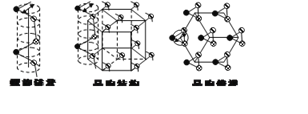
①螺旋链中Se原子的杂化方式为______________。
②己知正六棱柱的边长为a cm,高为b cm,阿伏加德罗常数为NA mol-l,则该晶胞中含有的Se原子个数为__________,该晶体的密度为_____________g/cm3(用含NA、a、b的式子表示)。
【答案】 ![]() As的4p能级是半充满状态,比较稳定,所以第一电离能比Se大 小
As的4p能级是半充满状态,比较稳定,所以第一电离能比Se大 小 ![]() 空间构型为正四面体,键角为10928′,SeO3空间构型为平面正三角形,键角为120 Se原子半径大于S原子半径,H—Se共价键更容易断裂 sp3杂化 9
空间构型为正四面体,键角为10928′,SeO3空间构型为平面正三角形,键角为120 Se原子半径大于S原子半径,H—Se共价键更容易断裂 sp3杂化 9 ![]()
【解析】(1)Se原子的原子序数是34,核外电子排布式为[Ar]3d104s24p4;(2)由于As的4p能级是半充满状态,比较稳定,所以第一电离能比Se大;(3)![]() 中Se形成4个
中Se形成4个![]() 键,孤对电子数为
键,孤对电子数为![]() =0,为sp3杂化,空间构型为正四面体,键角为10928′,SeO3分子中价层电子对个数=
=0,为sp3杂化,空间构型为正四面体,键角为10928′,SeO3分子中价层电子对个数= ![]() 键个数+孤对电子个数=3+
键个数+孤对电子个数=3+![]() (6-3×2)=3,且不含孤电子对,所以空间构型为平面正三角形,键角为120,所以SeO42-的Se―O的键角比SeO3的键角小;(4)由于Se原子半径大于S原子半径,H—Se共价键更容易断裂,即更容易电离出氢离子,所以H2Se比H2S水溶液的酸性强;(5)①根据晶胞结构可知螺旋链中每个Se原子形成2个共价键,另外含有孤对电子对=
(6-3×2)=3,且不含孤电子对,所以空间构型为平面正三角形,键角为120,所以SeO42-的Se―O的键角比SeO3的键角小;(4)由于Se原子半径大于S原子半径,H—Se共价键更容易断裂,即更容易电离出氢离子,所以H2Se比H2S水溶液的酸性强;(5)①根据晶胞结构可知螺旋链中每个Se原子形成2个共价键,另外含有孤对电子对=![]() =2,所以螺旋链中Se原子的杂化方式为sp3杂化;②Se原子间形成正六棱柱,位于面心与顶点,从晶胞的俯视图可知晶胞中Se原子数目为6×
=2,所以螺旋链中Se原子的杂化方式为sp3杂化;②Se原子间形成正六棱柱,位于面心与顶点,从晶胞的俯视图可知晶胞中Se原子数目为6×![]() +12×3×
+12×3×![]() =9,体积V=
=9,体积V=![]() ×a2×6×b,
×a2×6×b, ![]() =
=![]() =
=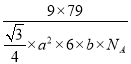 =
= ![]() 。
。

【题目】目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
已知H2的体积分数随温度升高而增加。
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/mol·L1 | [H2]/mol·L1 | [CH4]/mol·L1 | [H2O]/mol·L1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为_________。